Raybiotech抗体芯片在肝细胞癌相关激酶鉴定及治疗研究中的应用
杂志名称:Hepatology
文献题目:Wang X, Zhang M, Ping F, et al. Identification and Therapeutic Intervention of Co‐activated ALK, FGFR2 and EphA5 Kinases in Hepatocellular Carcinoma[J]. Hepatology, 2018.
第一作者:Xin Wang
通讯作者:Aijun Shen, Jian Ding, Meiyu Geng
作者单位:Division of Anti-tumor Pharmacology, State Key Laboratory of Drug Research,Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China.
本实验所用产品:Human RTK Phosphorylation Arrays C1 (AAH-PRTK-1)
实验样品:
肝细胞癌(HCC)肿瘤组织以及细胞系
研究背景:
肝细胞癌(hepatocellular carcinoma,HCC)是一种高死亡率的原发性肝癌。与多种病原因子相关(如病毒感染、酒精降解)。对于临床诊断的晚期病人,没有可行的有效治疗药物。基于“癌基因依赖”理念,在临床上有大量对肝细胞癌(HCC)激酶抑制剂的研究,但未找到主要的HCC依赖性激酶亚群,临床结果都不理想。近期,并发抑制多个激酶活化逐渐被公认为对治疗癌症有潜在优势,但大多实验都因激酶自身动态变化的性质而不成功。本文假设通过调控那些维持HCC细胞生存率的关键激酶可能获得最佳的治疗结果,从而进行靶向研究。

1 结果
1.1 ALK, FGFR2 和 EphA5同步激活调控HCC细胞生存率
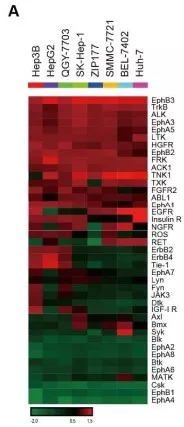
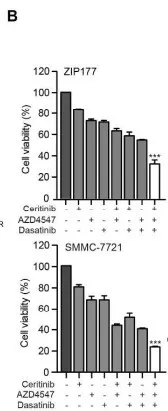
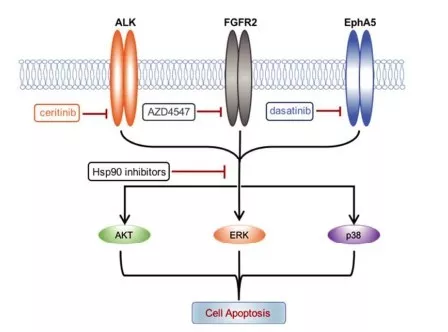
首先检测HCC细胞中酪氨酸激酶的基底激活状态。对细胞裂解,通过人类RTK磷酸化检测芯片,在8个HCC细胞系找出71酪氨酸激酶磷酸化异常。考虑到内在异质性,进一步在每个细胞系中选取了前20个激酶进行聚类分析,寻找同步激活激酶,发现17个激酶在细胞系中过度活化(图a)。判断几个关键激酶能否维持HCC的生长。通过两次筛选,ceritinib(色瑞替尼),AZD4547(FGFR2抑制剂)和dasatinib(达沙替尼)共同作用,明显抑制ZIP177和 SMMC-7721细胞的生长(图b)。
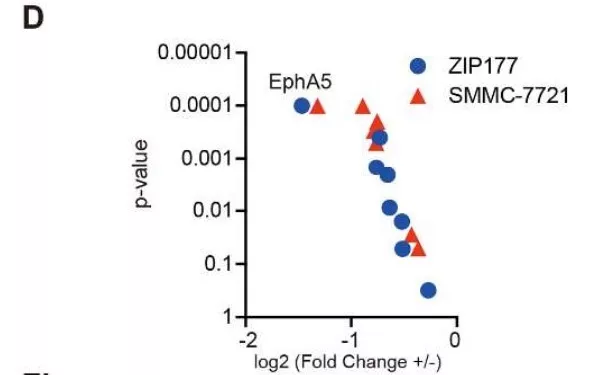
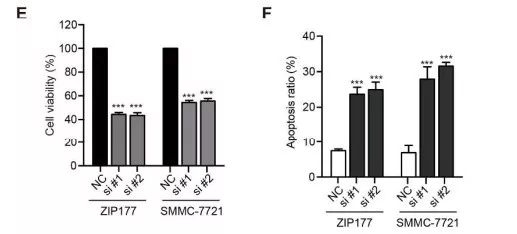
对dasatinib的作用激酶逐个敲除,对他们抑制细胞生长的能力进行评估,同ceritinib 和 AZD4547共处理,发现只有破坏EphA5能导致明显抑制作用,说明在HCC细胞中EphA5作为主要的dasatinib靶向蛋白(图d)。进一步破坏ALK,并沉默FGFR2 和EphA5的表达,发现在共同中断ALK, FGFR2 和 EphA5之后发生实质诱导凋亡(图e)。说明ceritinib, AZD4547和dasatinib靶向的ALK, FGFR2 和 EphA5,可能协同调控HCC细胞的生存率。
共同抑制ALK, FGFR2和 EphA5对下游信号级联反应进行探索,发现明显抑制了几个关键信号通路(p-AKT, p-ERK 和 p-p38),导致生长抑制和细胞凋亡(图fii)。说明ALK, FGFR2 和 EphA5能通过下游AKT, ERK 和 p38信号级联反应维持HCC细胞的生存率。

1.2 ALK, FGFR2和 EphA5异常活化与HCC患者不良预后相关
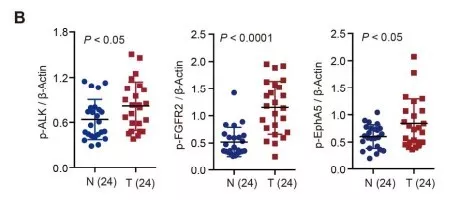
进一步评估ALK, FGFR2 和 EphA5同步激活能否用于HCC患者的治疗和预后,发现在HCC细胞系中p-ALK, p-FGFR2 和 p-EphA5高活化。通过24份HCC患者的肿瘤组织,进一步验证激酶的磷酸化,结果p-ALK, p-FGFR2 和 p-EphA5表达水平偏高(图b)。说明在HCC患者中ALK, FGFR2 和 EphA5异常活化。
对250份HCC样品进行组织微阵列分析,寻找潜在临床相关性。发现p-ALK,p-FGFR2和p-EphA5在不同患者身上变化较大。进一步亚组分析表明带有p-ALK,p-FGFR2和p-EphA5同步激活的亚群患者都有不良预后(图f)。说明p-ALK, p-FGFR2和 p-EphA5同步激活能使不良预后的HCC患者分层化,可用于对HCC干预治疗的研究。
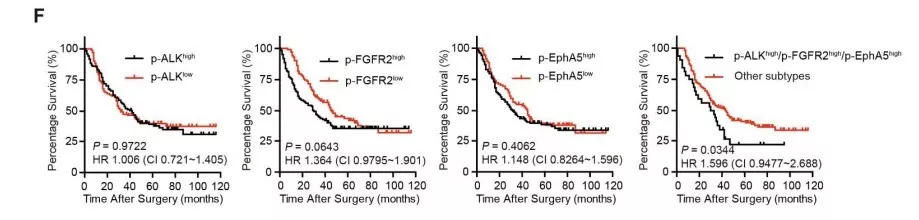
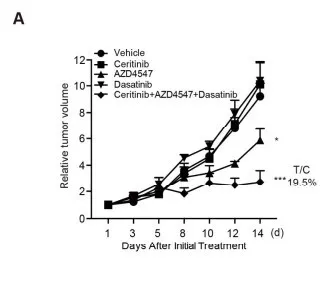
1.3 同时封闭ALK, FGFR2 和 EphA5能抑制肿瘤生长
进一步探究抑制ALK, FGFR2和 EphA5同步激活能否对HCC亚型有治疗优势。对SMMC-7721移植瘤小鼠模型进行药物处理(ceritinib、AZD4547和dasatinib),评估抑制肿瘤生长的能力,ceritinib, AZD4547和dasatinib共处理,明显抑制肿瘤生长(T/C=19.5%)(图a)。瘤内p-ALK,p-FGFR2 和p-EphA5的表达同其下游p-AKT, p-ERK 和 p-p38在共处理后都下调。这些结果说明了通过抑制ALK, FGFR2 和 EphA5激酶同步激活对HCC的治疗效果。
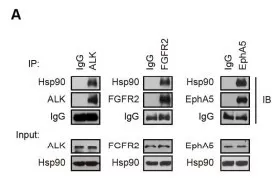
1.4 ALK, FGFR2和 EphA5是 Hsp90的受体蛋白
由于对ALK, FGFR2 和 EphA5直接靶向难以实现又带有不确定毒性,而激酶是最普遍的Hsp90(热休克蛋白)受体,其活性被Hsp90严格调控。探究Hsp90能否有效调节HCC细胞中ALK, FGFR2和EphA5的活性。免疫共沉淀分析判断ALK, FGFR2 和 EphA5是否是Hsp90的受体蛋白,结果在细胞中两者内源性相关(图a)。
对激酶进行ganetespib处理使其表达量下调,预先加入蛋白酶体抑制剂MG132的实验组激酶表达量正常(图f),说明蛋白稳定性受Hsp90抑制剂影响。这些结果暗示着在HCC细胞中ALK, FGFR2 和EphA5可能是Hsp90的受体蛋白。

1.5 Hsp90抑制剂通过终止ALK,FGFR2 和EphA5活化影响HCC细胞的生长
进一步弄清Hsp90和三个激酶的相关性,检测了Hsp90在肿瘤组织中的表达水平,发现Hsp90在肿瘤组织中表达量偏高。用siRNA敲除Hsp90导致明显的增殖抑制和HCC细胞凋亡(图e、f)。Hsp90敲除后,ALK, FGFR2和 EphA5的表达量和下游信号通路明显下调(图g)。ganetespib处理SMMC-7721移植瘤小鼠模型,结果肿瘤生长明显减少,同时没有明显的体重减轻现象, ALK, FGFR2, EphA5表达量和下游信号级联反应都减少。结果说明Hsp90抑制剂中的ALK, FGFR2, EphA5参与造成HCC生长抑制。
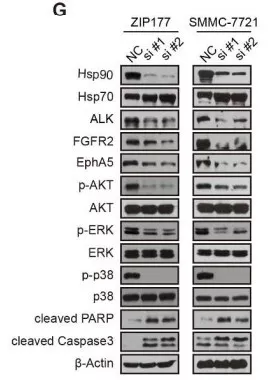
1.6 终止ALK, FGFR2和EphA5活化导致HCC派生瘤生长受到抑制
探究ALK, FGFR2 和EphA5同步抑制在临床上的治疗潜力。在8个派生瘤模型中,发现ALK, FGFR2 和EphA5同步激活,在LI0752 PDX中测试了ceritinib, AZD4547, dasatinib组合和ganetespib的抗癌活性,结果显示,ceritinib, AZD4547, dasatinib组合明显减少肿瘤面积(图a)。瘤内信号评估,发现抑制剂不能抑制AKT, p38 和ERK信号通路。Ganetespib处理LI0752,发现肿瘤生长抑制,没有发现体重变轻(图c),增加药量能使ALK, FGFR2, EphA5降解和下游信号下调。在派生瘤模型中,通过药物组合和Hsp90抑制剂共同抑制ALK,FGFR2和 EphA5的方法可行。AKT, p38和ERK接收三个激酶的信号,直接调控细胞生长。抑制下游信号可以导致细胞凋亡。
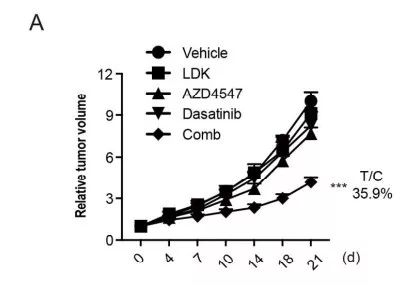
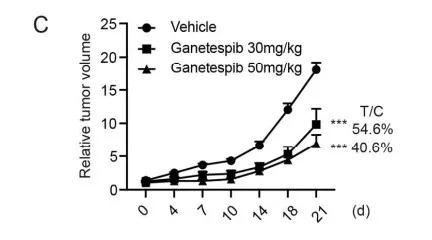
结论:
ALK, FGFR2 和EphA5同步激活与HCC病患不良预后密切相关。本文通过磷酸化检测芯片找出71酪氨酸激酶磷酸化异常,验证了ALK,FGFR2 和EphA5激酶通过下游的AKT, ERK 和 p38依赖性信号通路维持HCC细胞的生存力。本文表明ALK, FGFR2 和 EphA5激酶能共同调控HCC细胞的生长,这可能提供一种新概念——“联合靶向治疗”,用于HCC亚群患者诊断和之后的干扰治疗。
做芯片,找RayBio!





