Raybiotech抗体芯片在周细胞响应血小板衍生的PDGF-BB分泌促再生分子研究中的应用
杂志名称:Journal of Cerebral Blood Flow & Metabolism
文献题目:Pericytes secretepro-regenerative molecules in response to platelet-derived growth factor-BB. J Cereb Blood Flow Metab. 2018Jan;38(1):45-57.
第一作者:Abderahim Gaceb
通讯作者:Gesine Paul
作者单位:Translational NeurologyGroup, Department of Clinical Science, Wallenberg Neuroscience Center, LundUniversity, Lund, Sweden
本实验所用产品:AAH-GF-1、 AAH-CYT-3
实验样品: 成年人脑组织
研究背景:
脑周细胞不仅能维持解剖学,生物化学和免疫血脑屏障,而且体外显示其拥有间充质干细胞(MSCs)的特征。目前大量报道MSCs由于他们自身的分泌蛋白,而具有促进再生特性,然而,脑周细胞是否也拥有这样的粗再生特性目前未得到证实。因此,研究者描述了脑周细胞释放的分泌蛋白和微泡(MV)而介导的PDGF-BB/PDGFRß信号传导。在PDGF-BB上,周细胞不仅释放过多的生长因子和一组细胞因子,而且释放含有BDNF,FGFb,bNGF,VEGF和PLGF的MVs,作为对PDGFRß信号传导和激活ERK 1/2途径特异的应答。相反地,一种先天免疫系统的激活剂脂多糖(LPS),刺激更高量的主要炎性细胞因子的分泌并且激活NFkB通路,另外周细胞改变其形态,并经历表面标志物表达的相反变化。
研究者证明由于外源刺激,人脑周细胞的分泌组织变化很大,周细胞的差异分泌功能可能在调节神经炎症或促进神经修复中起重要作用,并且可能用于神经再生新的靶细胞。

1 结果
1.1 人脑周细胞表达典型的表面标志物
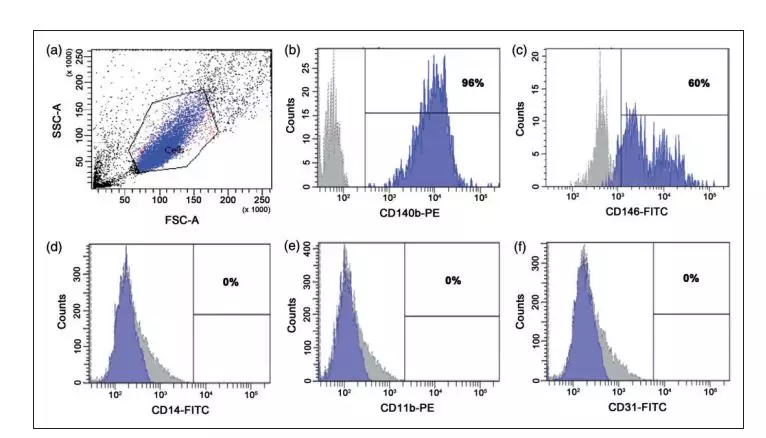
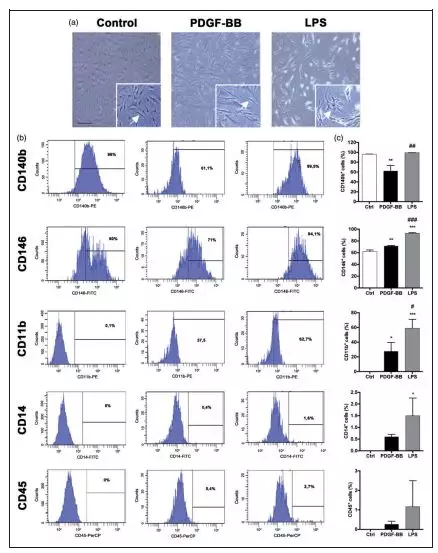
首先研究者在对照条件下验证了先前建立的成人人脑周细胞的表面标志物表达,通过使用细胞流式技术,然后分析细胞表面标志物表达是否存在周细胞标志物PDGFRß(CD140b)和CD146以及是否缺少单核细胞/巨噬细胞标志物CD14,小胶质细胞标记物CD11b和内皮细胞
标记物CD31(图片1a-f),结果证明CD140b和CD146高表达在人脑周细胞。
1.2 周细胞分泌生长因子响应于PDGF-BB
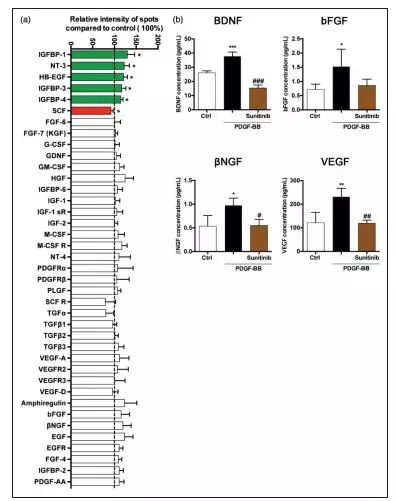
在中枢神经系统(CNS)中,由内皮细胞分泌的PDGF-BB在周细胞上结合PDGFRß并刺激周细胞的增殖和迁移并将其募集到血管并进入伤口区域。为了证明PDGF-BB是否也调控周细胞的分泌蛋白,研究者分析了PDGF-BB信号传导是否刺激脑周细胞生长因子分泌, 通过使用RayBio Human Growth Factor Antibody Array C(AAH-GF-1),得到PDGF-BB处理后的脑周细胞放出大量的几种营养生长因子如胰岛素样生长因子结合蛋白(IGFBP),神经营养因子3(NT3)和肝素结合的EGF样生长因子(HB-EGF),而与对照相比,PDGF-BB处理后干细胞因子(SCF)的释放减少(图2a)。接着,科研人员又分析了一组具有神经保护,神经再生或血管生成能力的特别有意义的生长因子,发现与对照组相比,在PDGF-BB处理后脑周细胞释放的BDNF(1.4-fold), bFGF (2-fold), bNGF(1.8-fold),VEGF(2-fold)明显增加。并且用PDGFRß激酶抑制剂抑制PDGF-BB诱导的生长因子释放,证实不同生长因子的分泌是通过PDGFRß特异性介导的(图2b)。
1.3 人脑周细胞释放的微泡含有响应PDGF-BB的生长因子
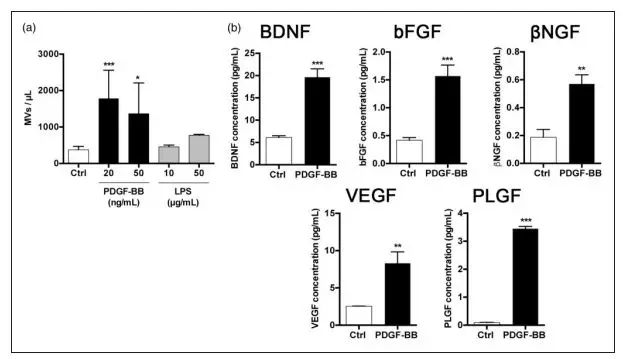
为了验证周细胞是否释放微泡,研究者量化和表征周细胞释放的MV,得到与未处理的细胞或LPS处理的周细胞相比,人脑周细胞释放出更多的MV(图3a)。接下来,分析了释放的MV是否含有相同的营养和血管生成因子在PDGF-BB处理的周细胞培养基中,验证了PDGF-BB处理后,MV中包含大量的BDNF,bFGF,bNGF, VEGF和PLGF(图3b)。
1.4 周细胞在PDGF-BB和LPS作用下释放多种细胞因子
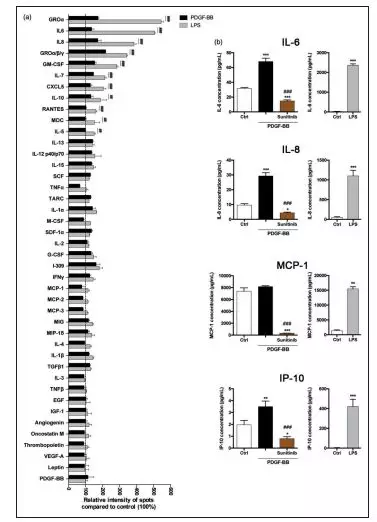
为了验证当用PDGF-BB处理时,除了生长因子之外,人脑周细胞是否释放细胞因子。研究者使用RayBioHuman Cytokine Antibody Array C3(AAH-CYT-3),得到LPS处理后诱导了具有主要促炎性质的细胞因子和趋化因子的显着释放,同时PDGF-BB处理后也得到相应趋势,但是没有LPS处理后影响大(图4a)。接下来为了研究PDGFRß信号传导对PDGF-BB介导的细胞因子释放的影响以及定量细胞因子的释放,分析IL-6,IL-8,MCP-1,CXCL10和IP-10的变化情况,得到PDGFRß激酶抑制剂可以抑制PDGF-BB分泌IL-6, IL-8, MCP-1,IP-10,证明人脑周细胞中细胞因子的分泌是PDGFRß介导的(图4b)。
1.5 在PDGF-BB和LPS作用下,人脑周细胞释放含有细胞因子的微泡
上述分析显示,PDGF-BB和LPS在人脑周细胞中诱导不同细胞因子的释放,因此研究者分析MV是否也含有这些细胞因子。通过实验证明,LPS处理后与未处理细胞或PDGF-BB处理细胞的MVs相比,MVs中IL-6、IL-8、MCP-1、IP-10含量明显升高(图5)。
1.6 PDGF-BB和LPS激活不同的信号转导途径
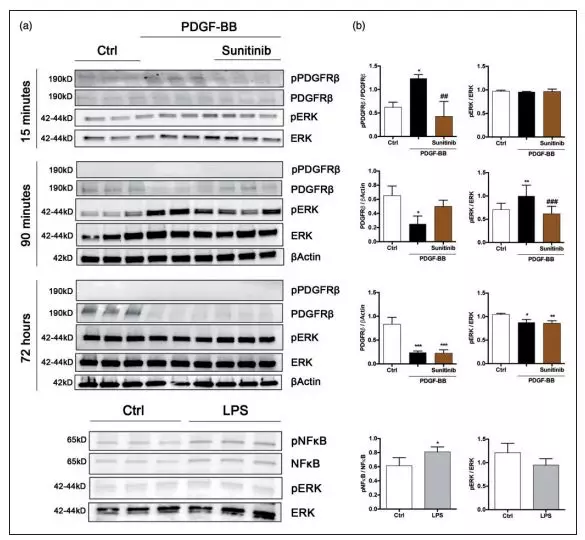
为了进一步调研PDGFRß介导的细胞信号通路,研究者用PDGF-BB处理人脑周细胞15分钟,90分钟和72小时,并用舒尼替尼预处理。通过实验得到,在15分钟时,PDGF-BB通过磷酸化PDGFRß蛋白表达的增加激活PDGFRß,而舒尼替尼预处理后完全抑制PDGF-BB诱导的PDGFRß磷酸化。在90分钟时,ERK1/2磷酸化显著增加,这是酪氨酸激酶受体激活的主要细胞内通路,而舒尼替尼阻止了ERK 1/2的活化,证实了PDGF-BB介导的PDGFRß下游通路的激活。在72小时,PDGF-BB和舒尼替尼均显著降低PDGFRß和ERK 1/2磷酸化。相反的,LPS处理的周细胞(24小时),通过磷酸化可以看出NFkß被激活,同时在LPS中,ERK1/2磷酸化水平有下降趋势,但没有达到显著水平。因此研究结果表明,PDGF-BB和LPS在人脑周细胞中激活不同的信号转导通路(图6a,b)。
1.7 PDGF-BB和LPS处理对周细胞形态和表面标记物表达有不同的调节作用
最后,研究分析了周细胞在两种不同刺激下是否表现出明显的形态学和表型变化。PDGF-BB治疗诱导了人脑周细胞的形态学改变,使细胞适应拉长的形状。相比之下,LPS治疗诱导了变形虫和分枝形状,让人想起小胶质细胞/巨噬细胞样的形态学(图7a)。此外,通过细胞流式,研究者分析了PDGF-BB和LPS影响周细胞表面标记物的表达,(图7b,c)
结论:
脑周细胞不仅可能成为中枢神经系统疾病中BBB保护和免疫调节的新靶点,而且可能由于其分泌能力而成为神经保护的新靶点。阐明受体和介导这种再生作用的下游通路对于指导新的再生药物靶点的开发至关重要。
做芯片,找RayBio!





