Raybiotech抗体芯片在肥胖与乳腺癌关系研究中的应用
杂志名称:ONCOLOGY LETTERS
文献题目:Zhao, Yuying, et al. "CXCL5 secreted from adipose tissue‑derived stem cells promotes cancer cell proliferation." Oncology letters 15.2 (2018): 1403-1410.
第一作者:YUYING ZHAO
通讯作者:Qingyuan Zhang
作者单位:Department of Medical Oncology, The Fourth Affliated Hospital of Harbin Medical University,Harbin, Heilongjiang 150001 RTK Phosphorylation
本实验所用产品:RayBio G-Series Human Cytokine Antibody Array kit(AAH-CYT-G2000)
实验样品:
乳腺癌细胞
研究背景:
肥胖是导致许多疾病的高危因素,超重或肥胖的绝经后妇女患有乳腺癌的风险相对较高。乳腺癌与肥胖的相关性在流行病学中已有记录,但两者相关性的分子机制尚未完全明确。脂肪干细胞(adipose-derived stem cells,ASCs),是近年来从脂肪组织中分离得到的一种具有多向分化潜能的干细胞,可分化成多种细胞类型,如纤维细胞,肌成纤维细胞、内皮细胞和巨噬细胞等,能分泌不同的细胞因子(蛋白),如趋化因子和生长因子,并构成细胞微环境,调控上皮细胞的增殖。已有研究表明,早期乳腺癌中,某些细胞因子(如IL-6, IL-8 、CXCL5)的表达与细胞低分化、较差的临床结果相关,但参与ASCs和乳腺癌细胞相互作用的特异性因子是否促进乳腺癌的发生,还有待确定。为确定ASCs是否促进乳腺癌的发生和发展以及作用机制,采用不同乳腺癌细胞,评估ASCs及其产物对细胞增殖的作用。

1 结果
1.1 ASCs同癌细胞共培养对乳腺癌细胞增殖的影响
从脂肪组织中分离出ASCs同癌细胞共培养,评估它们对雌激素受体阳性和阴性的MDAMB-231细胞的诱导增殖作用(Fig.1B)。WI‑38 纤维母细胞作为阳性对照(已有研究表明,WI‑38 纤维母细胞能促进肿瘤生长)。结果表明,ASCs的作用效果不受雌性激素的影响,在同ASCs共培养的雌性激素阴性细胞和阳性细胞中,都有促进细胞增殖的作用。
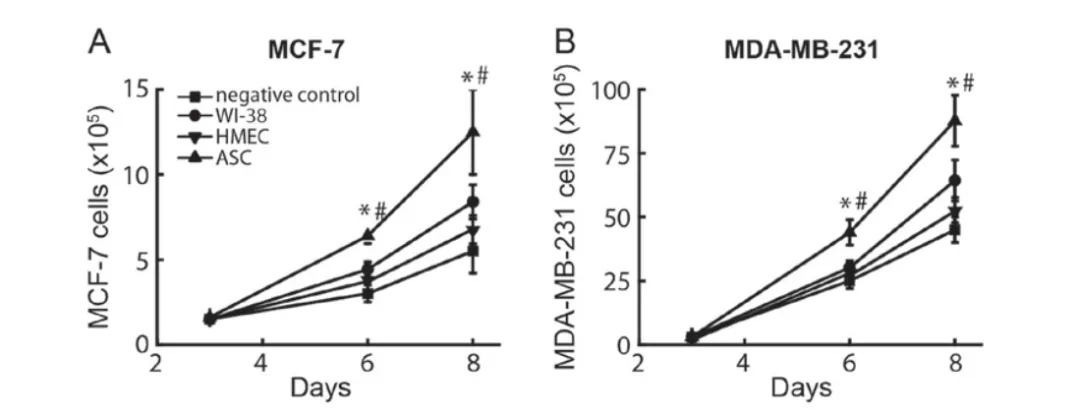
1.2 ASCs-癌细胞共培养液对乳腺癌细胞增殖的影响
在本实验条件下,乳腺癌细胞与癌细胞间几乎没有直接接触。为了证实ASCs分泌的蛋白可能起到刺激癌细胞增殖的作用,采用条件共培养基替代同ASCs共培养。ASCs和乳腺癌细胞共培养第6天,收集培养基上清液作为生长培养基,作用于MCF-7细胞 (Fig.2A) 和MDA-MB-231 细胞(Fig. 2B)。使用ASCs-癌细胞共培养液培养的MCF-7和MDA-MB-231细胞数目相对于常规培养基的细胞数目有明显的增长。结果表明,ASCs分泌的蛋白具有刺激癌细胞增殖的功能。
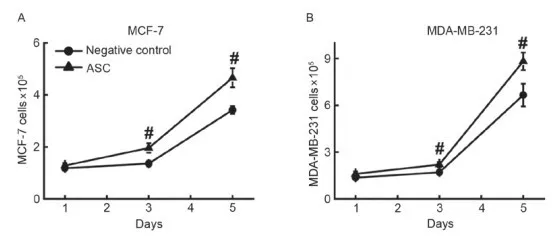
1.3 ASCs-癌细胞共培养液中的趋化因子
为了判断是哪些因子促进乳腺癌细胞的增殖,采用Raybio抗体芯片检测ASCs-癌细胞共培养基上清液中174个不同的蛋白,分析出ASC-条件培养基和常规培养基之间的差异蛋白(Fig.3A)。ASCs-癌细胞共培养液中CXCL5、ENA-78、MCP 2、MCP3和RANTES蛋白表达水平明显上调,其中CXCL5表达水平上调最明显,且CXCL5, MCP2, MCP3, ENA-78和 RANTES在WI‑38/乳腺癌细胞共培养中无明显变化,结果表明,CXCL5在ASCs中特异性表达。
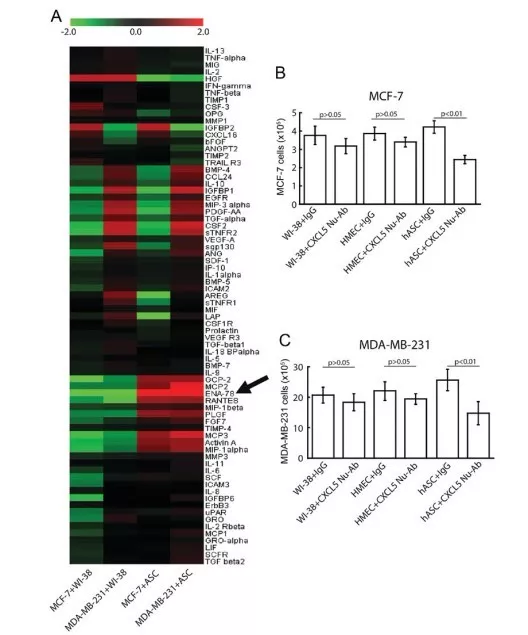
1.4 中和CXCL5蛋白对ASCs促进作用的影响
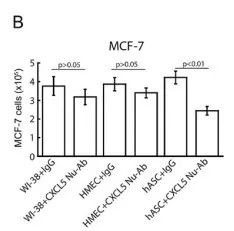
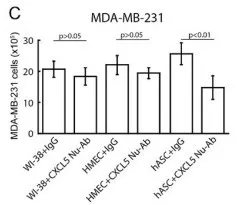
采用CXCL5特异性抗体中和CXCL5,检测同WI‑38细胞, HMECs 和 ASCs细胞共培养的乳腺癌细胞数目变化,探究细胞旁分泌CXCL5促进乳腺癌增殖的潜力。共培养第4天,在乳腺癌细胞MCF‑7(Fig.3B)MDA‑MB‑231(Fig.3C)[h1] 中,上述CXCL 5特异性抗体对ASC促进增殖的活性有明显抑制作用。相反地,共培养第4天, CXCL5抗体对同WI‑38 细胞、HMECs共培养的乳腺癌细胞没有明显影响。结果表明,anti-CXCL5特异性抗体针对ASCs -条件培养基起抑制作用的。
结论:
本研究通过共培养实验确定了ASCs对乳腺癌增殖有促进作用,进一步采用细胞因子芯片检测共培养基上清液中174个蛋白的表达水平,找出CXCL5表达水平明显上调,且采用抗体特异性中和CXCL5蛋白对ASC促进增殖的活性起到抑制作用,说明在促进乳腺癌细胞增殖,ASC分泌的CXCL5是关键因子。
做芯片,找RayBio!





