RayBiotech抗体芯片在组织蛋白酶D与hepsin泛素 - 蛋白酶体降解增强乳腺癌的侵袭和转移研究的应用
杂志名称:Cancer letters
文献题目:Zhang C, Zhang M, Song S. Cathepsin D enhances breast cancer invasion and metastasis through promoting hepsin ubiquitin-proteasome degradation[J]. Cancer letters, 2018, 438: 105-115.
第一作者:Chunyi Zhang
通讯作者:Shushu Song
作者单位:Department of Biochemistry and Molecular Biology, Schoolof Basic Medical
Sciences, Fudan University, Shanghai 200032, China
本实验所用产品:Human inflammation antibody array
实验样品:乳腺癌细胞培养上清
研究背景:丝氨酸穿膜蛋白酶(Hepsin)是正常形态的生长和维持所必需的,也是细胞运动和发育,血液凝固和促炎免疫反应响应所必需的。研究者发现组织蛋白酶D参与hepsin的调节,CtsD通过促进其泛素化和随后的乳腺癌蛋白酶体降解来破坏hepsin的稳定性。乳腺癌组织微阵列还表明,通过免疫组织化学发现hepsin表达与CtsD呈负相关。其中,过表达的CtsD通过在体外和体内增强细胞间细胞粘附分子-1(ICAM-1)的表达来促进乳腺癌细胞迁移,侵袭和转移,这些效应被异位的hepsin表达抑制。因此,研究者的数据揭示了迁移和转移中关键的CtsD-hepsin信号轴,这可能有助于更好地理解其在乳腺癌进展中的功能和分子机制。

1 结果
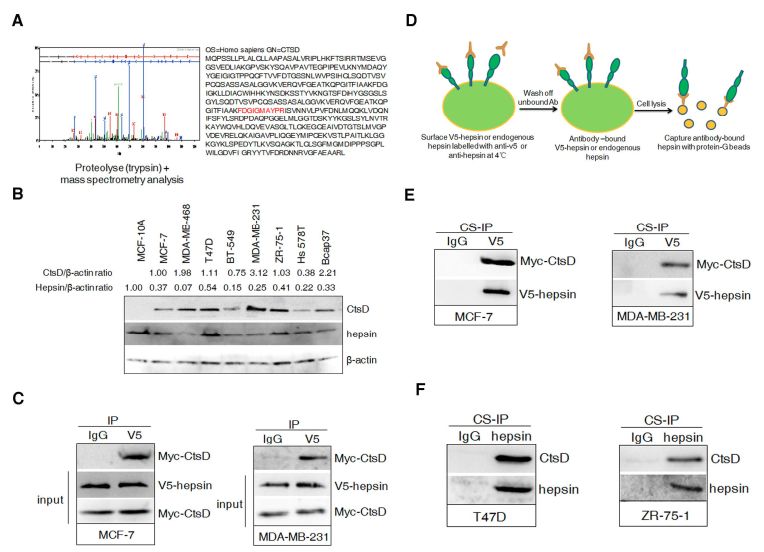
1.1 鉴定CtsD作为hepsin的结合蛋白
首先研究者用IgG或抗v5hepsin抗体获得的免疫沉淀物在sds -聚丙烯酰胺凝胶上进行分离,接着用质谱法显示了11个连续氨基酸的测序(图1A)。由于CtsD是乳腺癌预后不良的标志,因此研究者在不同的BCC和正常人乳腺上皮(MCF-10A)细胞系中检测到CtsD和hepsin的表达。WB分析显示,与MCF-10A相比,BCC表现出升高的CtsD和降低的hepsin表达,尽管程度不同(图1B)。为了确定CtsD是否与hepsin相互作用,研究者在具有V5-hepsin和myc-CtsD转染的MCF-7和MDA-MB-231细胞中进行了免疫共沉淀实验,在裂解物中很容易检测到与hepsin有关的CtsD(图1C)。为了确定CtsD是否在细胞表面结合hepsin,研究者在4°C用V5或hepsin特异性抗体标记表面hepsin(图1D),在MCF-7和MDA-MB-231细胞表面证实hepsin和CtsD外源性的相互作用(图1E),同时内源性CtsD和hepsin相互作用在T47D和ZR-75-1细胞中也观察到(图1F)。
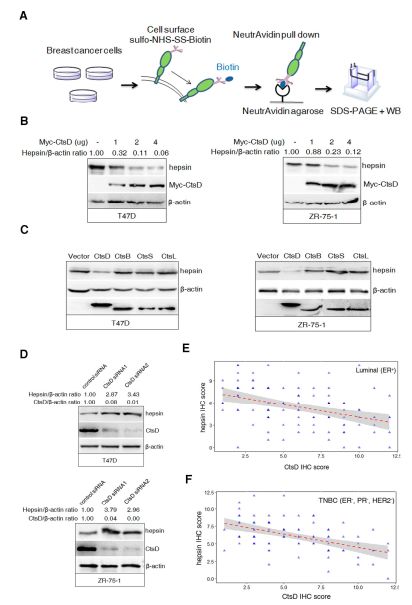
1.2 CtsD调控BCC中hepsin的表达
由于CtsD可与人BCC中的hepsin相互作用,累积的CtsD蛋白可能有助于调节BCC中hepsin的表达,所以研究者用生物素细胞表面蛋白的标记和western检测了hepsin的膜表达(图2A)。CtsD的异位表达以剂量依赖性方式显着下调细胞表面hepsin蛋白水平。 使用对照组,发现在细胞裂解物中检测到β-肌动蛋白,但在标记的表面蛋白中未检测到β-肌动蛋白(图2B)。 作为另一种对照,当细胞转染CtsB, S 和L时,生物素标记的膜hepsin没有改变 (图 2C)。此外,敲除的CtsD诱导T47D和ZR-75-1细胞中hepsin表达的上调(图2D)。为了检查临床乳腺癌中hepsin和CtsD之间的相关性,通过组织微阵列载玻片上的免疫组织化学染色分析CtsD和hepsin蛋白水平,得到hepsin表达与管腔乳腺癌(图2E)和TNBC(图2F)中的CtsD表达呈负相关。
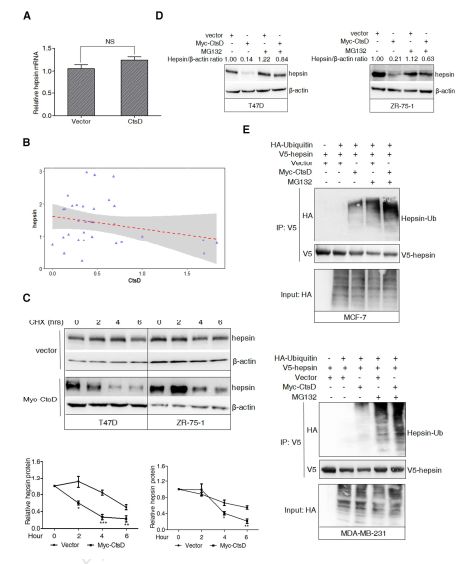
1.3 CtsD通过泛素化促进hepsin降解
为了确定CtsD是否在转录水平下调hepsin蛋白,进行实时PCR,结果显示,CtsD转染对MCF-7细胞中的hepsinmRNA水平没有影响(图3A),表明CtsD主要在转录后水平调节hepsin表达,结果还显示,在32个原发性人乳腺癌样品中,hepsinmRNA水平与CtsD无相关性(图3B)。为了确认CtsD是否影响hepsin稳定性,环己酰亚胺(CHX)追踪实验显示,发现hepsin蛋白在myc-CtsD转染条件下半衰期缩短,与对照条件相比,揭示CtsD在体外促进hepsin的降解(图3C)。为了证明CtsD诱导的hepsin降解是否由蛋白酶体通路介导的,研究者用蛋白酶体抑制剂MG132处理T47D和ZR-75-1细胞,发现MG132明显的阻断了CtsD诱导的hepsin降解(图3D)。研究者采用泛素化梯度法检测hepsin泛素化的变化,用HA标记的泛素,V5-hepsin表达质粒和空载体或myc-CtsD构建体转染MCF-7和MDA-MB-231细胞48小时,并用MG132或载体处理5小时(图3E),通过CtsD转染检测到hepsin的聚泛素化信号,此外,在MG132存在下,hepsin的泛素化进一步增强。这些结果表明,CtsD通过促进其泛素化和随后的蛋白酶体介导的降解来下调hepsin的表达。
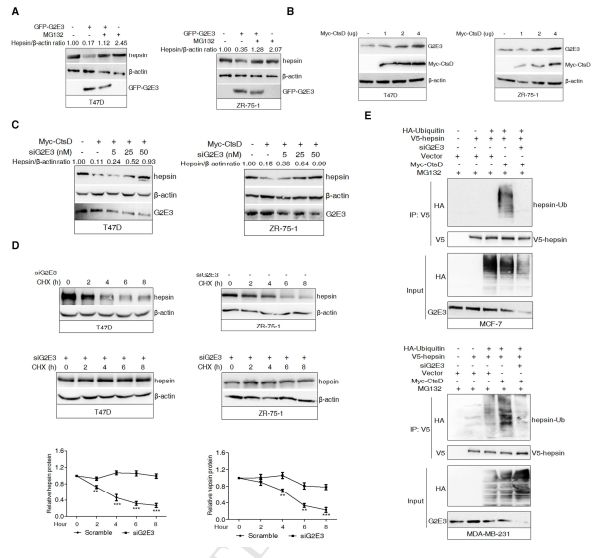
1.4 G2E3以hepsin为降解目标
为了调查CtsD诱导hepsin蛋白酶体降解的机制,研究者通过质谱鉴定它是E3连接酶,G2 /M期特异性E3泛素- 蛋白质连接酶(G2E3)作为hepsin的公认的E3连接酶,在T47D和ZR-75-1细胞中过表达GFP-G2E3导致hepsin显着降低(图4A)。如图4B所示,CtsD的异位表达以剂量依赖性方式显着上调G2E3蛋白水平。使用干扰RNA靶向G2E3基因,会得到阻断G2E3表达可以立即抑制由CtsD诱导的hepsin降解,并呈剂量依赖性(图4C)。同时, CHX追踪实验显示G2E3敲低可以阻断由CtsD诱导的hepsin的半衰期减少(图4D)。此外,在CtsD诱导下检测到hepsin的聚泛素化信号,而在敲除G2E3后HA标记的泛素不再能够被检测到或者更少被检测到(图4E)。
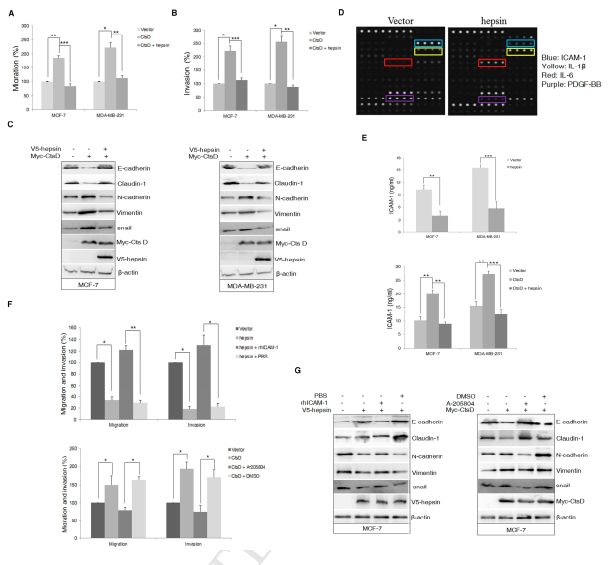
1.5 CtsD通过体外下调hepsin促进乳腺癌的迁移和侵袭
进一步评估CtsD和hepsin在乳腺癌中的预后价值,体外细胞迁移侵袭实验表明CtsD的过表达促进了BCC的迁移和侵袭,hepsin的额外表达抑制了这种作用(图5A,B)。CtsD表达诱导上皮标志物(E-钙粘蛋白和紧密连接蛋白-1)的下调和间充质分子(N-钙粘蛋白)的上调,外源性hepsin在CtsD-过表达细胞中的表达在很大程度上挽救了E-钙粘蛋白和Claudin-1的表达(图5C)。此外,肿瘤微环境的变化有助于癌症的发展,因此研究者使用RayBioHuman inflammation antibody array评估在MCF7中hepsin对细胞因子模式的全局影响,发现IL-6 和 IL-1β略微增加,而ICAM-1和PDGF-BB明显减少(图5D)。ELISA也分别证实了转染hepsin后这些因子的分泌发生了变化(图5E),并且发现CtsD促进了ICAM-1的分泌,对其他因子的分泌没有影响。如图5F,rhICAM-1促进hepsin体外转染MCF-7细胞迁移和侵袭,相反的,抑制剂A-205804降低了CtsD转染的MCF-7细胞的迁移和侵袭。此外,加入 rhICAM-1,部分抑制E-cadherin和claudin-1上调,并增加hepsin转染的MCF-7细胞中的Vimentin,N-cadherin和snail表达,ICAM-1抑制剂A-205804在CtsD转染的MCF-7细胞中发挥相反的作用。(图5G)
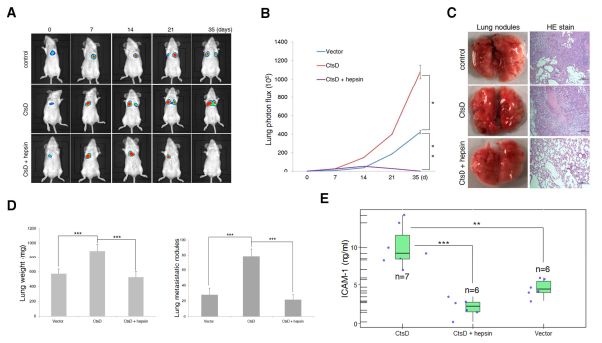
1.6 Hepsin在体内挽救CtsD诱导的乳腺癌转移
为了直接评估CtsD是否促进体内转移,研究者将CtsD过表达的MCF-7-luc细胞静脉内注射到雌性SCID小鼠中,并使这些小鼠进行生物发光成像。CtsD-过表达细胞表现出越来越多的肺结节(图6A和B),这意味着CtsD可以在体内促进BCC转移。图6C,D为注射35天后,所有对照小鼠每只小鼠平均有30个可见的转移性结节,相反,注射CtsD过表达细胞的小鼠由于大量肺转移而垂死,每只小鼠平均有80个可见的转移性结节,组织切片也肉眼观察到大量的由CtsD-过表达细胞产生的转移性病变。由于这种趋化因子从肿瘤细胞分泌到肿瘤微环境和血液中,小鼠ICAM-1可在血浆中检测到约4.5ng / ml的水平,并且携带CtsD过表达细胞的小鼠血浆中ICAM-1表达显着增加,外源性hepsin在CtsD过表达细胞中的表达在很大程度上抑制了ICAM-1的产生(图6E)。
结论:
在这项研究中,研究者发现CtsD的过表达增加了G2E3的水平,因此促进了hepsin的泛素化和降解,人体腔和TNBC标本上CtsD,hepsin和G2E3之间的紧密相关性证实了它们的潜在调节,G2E3通过翻译后修饰影响了hepsin的稳定性。此外,除泛素化,hepsin在BCC上的表达可能受其他因素的调节和信号通路,之前的研究表明,不同的调节因子可能通过蛋白质 - 蛋白质相互作用和亚细胞定位影响hepsin的功能。显然,这些结果扩展了hepsin的调节机制。
肿瘤来源的ICAM-1鉴定为关键参与CtsD-hepsin介导的乳腺癌转移调控因子,hepsin调节乳腺癌的迁移和转移是在肿瘤微环境中刺激和抑制因子之间平衡的严格调节。研究者推测hepsin表达可能促进或抑制肿瘤取决于肿瘤发生的阶段和肿瘤微环境的变化。尽管上述不确定因素仍在等待未来研究,但上述数据证实了CtsD通过促进hepsin泛素 - 蛋白酶体降解来增强乳腺癌侵袭和转移。
做芯片,找RayBio!





