RayBiotech抗体芯片在肌球蛋白II通过免疫微环境对肿瘤的进展研究中的应用
杂志名称:Cell
文献题目:Georgouli M, Herraiz C, Crosas-Molist E, et al. Regional activation of myosin II in cancer cells drives tumor progression via a secretory cross-talk with the immune microenvironment[J]. Cell, 2019, 176(4): 757-774. e23.
第一作者:Mirella Georgouli
通讯作者:Victoria Sanz-Moreno
作者单位:Barts Cancer Institute,John Vane Science Building, Charterhouse Square, Queen Mary University ofLondon, London EC1M 6BQ, UK
本实验所用产品:AAH-CYT-4000
实验样品:细胞培养上清
研究背景:
转移占癌症相关死亡的90%以上,这表明了迫切需要临床管理。离开原发肿瘤,癌细胞使用不同的迁移模式传播。尽管集体细胞迁移对于组织重塑很重要,但是单细胞迁移(圆形变形虫或细长间充质)允许在实时位点和远端部位进行运输,以及通过基底膜的侵入。由肌球蛋白II驱动肌动蛋白的收缩性进行细胞骨架重塑和肿瘤扩散。ROCK可以直接磷酸化肌球蛋白轻链2(MLC2)或间接降低肌球蛋白磷酸酶(MYPT)活性增加MLC2磷酸化,ROCK也可激活LIMK磷酸化和灭活cofilin影响 F-肌动蛋白稳定性。肌球蛋白II驱动高水平的肌动球蛋白收缩,这是维持变形虫疱疹移植的关键。黑色素瘤和乳腺癌异种移植小鼠的活体成像显示变形虫迁移是有利于肿瘤侵入前沿(IFs)另一方面,癌症相关的炎症在许多层面促进肿瘤发生。炎症的产生是由多种因子的分泌和免疫细胞的募集,像单核细胞。单核细胞区别于巨噬细胞,他们可以改变自己的表型去响应微环境信号。经典活化的巨噬细胞是通过响应促炎刺激而诱导的,如脂多糖(LPS)或干扰素γ(IFN-g)并表现出细胞毒性功能。其中细胞因子例如白细胞介素(IL)-4,IL-13和IL-10,转化生长因子β(TGF-β)和/或糖皮质激素作为可以支持交替激活的巨噬细胞(AAMs)促进组织修复和肿瘤进展。
因此,研究肌球蛋白II在癌细胞中的活性通过建立与促炎核因子kB(NF-kB)的交互作用,控制调节肿瘤微环境(TME)的因子的分泌意义重大。

1 结果
1.1 人类黑色素瘤的侵入性前沿富集在变形虫黑色素瘤细胞靠近巨噬细胞和血管
之前已经报道了在移植瘤模型中肿瘤侵袭边缘变形虫的迁移富集,为了测试在人体组织中此情况的发生,研究人员我们使用组织评估人黑素瘤活组织检查微阵列(40个人黑色素瘤病变,队列A)和较小的队列(7个黑色素瘤病变,队列B)。由图1A发现人原发黑素瘤的IF在圆形癌细胞中富集,而与肿瘤体中的形态无关,图1B显示在IF中区域性的增加磷酸MLC2水平可以指导高肌球蛋白II活性。紧接着为了确认A组患者中巨噬细胞组成的区域差异,从图1C,1D和1E得到,CD163+和CD206+肿瘤相关的巨噬细胞(TAM)富集在肿瘤Ifs上,而在CD68+细胞中无区域差异。研究者还得到在相同的肿瘤区域中巨噬细胞丰富的地方血管密度升高(图1F)。侵袭性肿瘤中的TME可能有利于形成由癌细胞,内皮细胞和巨噬细胞组成的转移前“侵入性龛”,转移性黑色素瘤病变均在靠近血管的圆形黑素瘤细胞和CD206+TAMs中富集。(图1G和1H),并且在数据库里得到转移性与原发性人黑色素瘤中增加了CD206+mRNA水平(图1J)。总体而言,人类黑色素瘤的IFs富含变形虫黑色素瘤细胞,这些与特定的TME相关联。特别地,肿瘤转移部位的TME表明存在黑素瘤的IFs,即为变形虫相关的TME(图1K)。

1.2 黑色素瘤细胞中肌球蛋白II的活性有利于分泌免疫调节因子
肿瘤细胞与正常细胞的交流通过分泌因子来介导。A375M2是高转移性圆形黑色素瘤细胞,具有高的肌球蛋白II活性,而A375P细胞肌球蛋白II活性明显低于A375M2(图2A)。通过使用RaybioAAH-CYT-4000芯片,研究者发现,相比A375P有155种蛋白高表达于A375M2,基于他们倍数的变化这些因子被分为三组,其中IL-3,IL-4,IL-5,和IL-13更为显著,并通过ELISA验证A375M2分泌高水平的促炎症IL-1a,IL-8和免疫抑制性IL-10和TGF-b(图2B,2C)。蛋白的分泌依赖于肌球蛋白,由于MLC2从 A375M2中耗尽,分泌的细胞因子和趋化因子明显减少(图2D)。通过RNA干扰去除肌球蛋白关键调节因子ROCK,得到蛋白质分泌减少,这些结果同样在ROCK抑制剂中得到证明。(图2E,2F)研究者为了进一步扩展到黑色素瘤配对细胞系WM983B(转移性)/WM983A(原发性)中,发现WM983B相比WM983A具有高水平的p-MLC2,更易于分泌(图2G)。为了评估肌动蛋白-ROCK的重要性,分别去除MLC2及干扰ROCK,得到分泌的细胞因子明显减少(图2H,I)。因此证明免疫调节因子的分泌,在黑素瘤进展中很重要并受黑素瘤细胞中ROCK-MyosinII活性的调节。
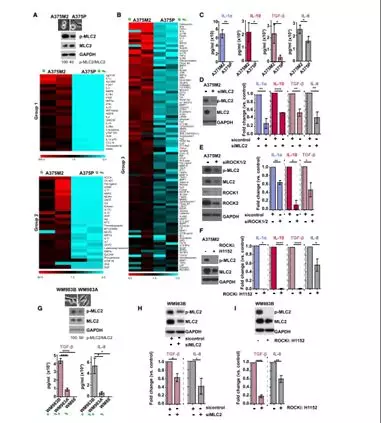
1.3 变形虫黑色素瘤细胞诱导促肿瘤巨噬细胞
人外周血单个核细胞迁移(PBMC)衍生的单核细胞和单核细胞系(THP-1和U-937)增加了分泌因子更多衍变为变形虫A375M2细胞相比于A375P细胞(图3A)。研究者为了验证单核细胞是否能相应A375M2细胞而分化成巨噬细胞,发展一系列体外极化巨噬细胞(图3B),得到IL-4诱导CD206,IL-10诱导CD163,IFN-g和LPS诱导CD86表达,更显著的是A375M2诱导CD163+ CD206 +巨噬细胞比A375P更有效(图3C,D)。CD206表达增加在巨噬细胞中通过诱导的A375M2与IL-4刺激之后相当,A375M2-和A375P处理的巨噬细胞,经典活化标志物:HLA-DR和CD86均未显示出表达水平的差异(图3E,F)。此外研究者发现A375M2,IL-4,M-CSF和IL-10诱导的巨噬细胞保留了指示分化的混合形态,并且细胞伸长,AAMs的特征在A375M2处理的巨噬细胞中是显著的,而在IFN-g和LPS处理后或在未处理的单核细胞中最小(图3G)。为了研究变形虫黑色素瘤细胞诱导巨噬细胞的功能,进行了肿瘤细胞杀伤实验(图3H),得到IFN-g和LPS处理后巨噬细胞可以杀死A375M2和WM88细胞(图3I)。研究者接下来使用来自黑素瘤患者和健康供体的血清治疗PBMC衍生的单核细胞,黑素瘤患者来源的血清比正常组诱导更高水平的CD163+CD206+巨噬细胞,而HLA-DR和CD86水平保持不变。(图3J-3L)。
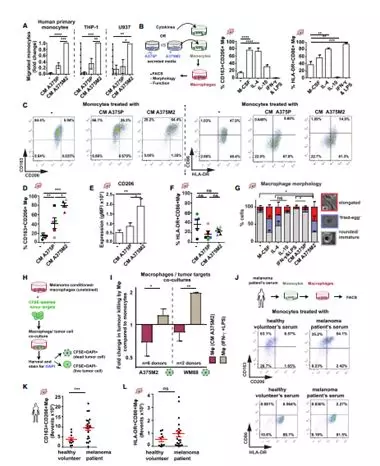
1.4 AATME的组成是体内黑色素瘤的一个保守特征
接下来为了验证黑色素瘤细胞中高活性的肌球蛋白II是否对巨噬细胞的寡母有影响,研究者将高活性的MyosinII A375M2-EGFP细胞与对照组A375P-EGFP注射在SCID小鼠,发现A375M肿瘤明显生长快于A375P(图4A,B)。设计五组磷酸化MLC2浓度由低到高,证明A375M肿瘤在任何地方MyosinII活性比A375P高,特别地,在IFS中MyosinII活性明显增加(图4C,D),而在A375M肿瘤IFs中高活性的MyosinII伴随着TAMs中F4/80+CD206+的高浸润与血管密度相结合(图4E-H)。同样的,高活性的MyosinIIWM983B-EGFP细胞与对照组WM983A-EGFP注射在SCID小鼠,同样的WM983B肿瘤明显生长快于WM983A肿瘤,并且WM983B肿瘤高MyosinII表达活性以及在IFs的TAM中F4/80+CD206+有着高渗透性(图4I-M)。接下来,为了确保在所有免疫成分存在下可以产生AATME,将高转移性的和变形虫B16F10细胞注射到具有免疫活性的C57BL/6J细胞,实验得到圆形黑色素瘤细胞中MyosinII有着很高的水平,并且在IFs中TAMs 的F4/80+CD206+增加(图4N-O)。此外,原为接种的变形虫5555细胞有着丰富的高活性MyosinII的圆形癌细胞,且F4 /80 + CD206 + TAM渗透,这些都证实了AATME在几种体内黑色素瘤中是一个保守的特征。
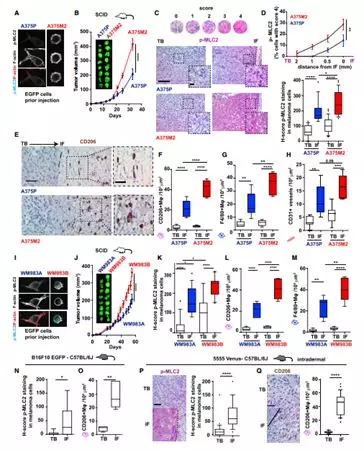
1.5 阻断黑色素瘤细胞中肌球蛋白II活性重编巨噬细胞
为了调查变形虫肿瘤细胞的ROCK-MyosinII轴是否对极化的巨噬细胞有影响,研究者将单核细胞与使用三种不同ROCK抑制剂的A375M2细胞共培养(图5A),实验得到ROCK抑制的A375M2细胞不能产生巨噬细胞CD163+CD206+(图5B)。此外,当将MLC2的干扰RNA转染到A375M2中,巨噬细胞CD163+CD206+同样很少,而HLA-DR+CD86+巨噬细胞没有发生变化(图5C)。A375M2诱导的巨噬细胞在HMVEC和HUVECs中维持内皮细胞生长比在ROCK抑制A375M2细胞处理的巨噬细胞效率要好。为了证实ROCK-MyosinII活性在体内控制AATME的作用,5555细胞细胞用ROCKi离体预处理然后注入C57BL/ 6J小鼠的真皮中,没有任何进一步的ROCKi治疗(图5E)。14天后,发现黑色素瘤细胞通过变形虫侵入真皮中(图5F)。与此同时,ROCKi处理的肿瘤组显示侵入的变形虫黑素瘤细胞明显丧失以及TAMsF4/80+CD206+减少(图5G-J)。为了将实验得到的成果放到临床上验证,使用药物在既定肿瘤中全身给药,其中用ROCKi处理携带A375M2-EGFP肿瘤的小鼠。结果得到在ROCKi处理后肿瘤生长减少,这与环形黑素瘤瘤细胞缺失,F4/80+CD206+TAMi 侵润减少以及在IFs的血管系统减少有关(图5K-N)。
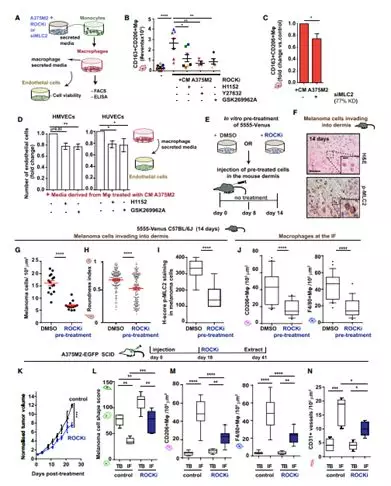
1.6 黑色素瘤细胞中肌球蛋白II活性是自我延续的通过分泌IL-1a诱导NF-kB的激活
为了评估蛋白质分泌是否会影响肌球蛋白II活性本身,用A375M2处理A375P细胞。并显示圆形细胞以及p-MLC2水平的增加(图6A),因此变形虫黑色素瘤细胞可通过旁分泌诱导其他黑色素瘤细胞成变形虫特征。用BFA处理的A375M2细胞阻止预先存储的可溶性因子和受体的运输,显示出圆形细胞的损失以及p-MLC2水平的减少(图6B)。接下来,研究者以NF-kB作为变形虫黑色素瘤细胞分泌中心网络做蛋白质互作(图6C),并用western验证蛋白分泌NF-kB活性,并且得到A375M2处理A375P细胞后p-IkBa水平增加(图6D)。相反的,消耗A375M2中MLC2会使得p-IkBa水平减少,证明了MyosinII控制NF-kB活性(图6E,F)。此外,变形虫A375M2黑色素瘤细胞相比A375P细胞有高的NF-kB活性(图6G)。为了验证NF-kB是否会影响IL-1a和 IL-8活性,研究者分别敲除IL-1a以及IL-8,来观察其相互影响,证明MyosinII控制NF-kB活性是通过分泌IL-1a得到。(图6H,I)耗尽NFKB1的A375M2细胞丧失细胞圆度和p-MLC2皮质水平(图6J,K)。最后总结得到MyosinII,IL-1a,NF-kB之间的关系(图6L)。
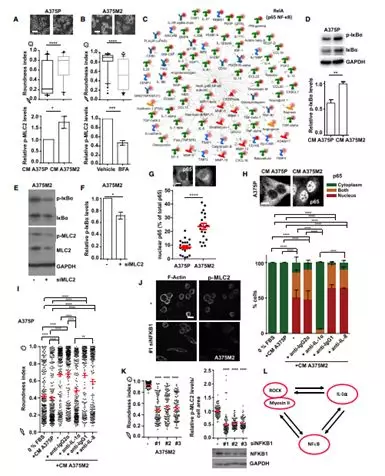
1.7 NF-kB与变形虫黑色素瘤细胞ROCK-MyosinII交互发生于肿瘤微环境中
研究者发现去除A375M2细胞中的NFKB1会导致对单核细胞的趋化能力降低,此外,也会降低变形虫黑色素瘤MyosinII活性,分泌潜能以及巨噬细胞的极化(图7A)。如果治疗HMVEC来自于ROCK1/ 2耗尽或NFKB1耗尽的A375M2细胞,则A375M2诱导的作用丧失(图7B,C)。内皮细胞的骨架变化影响内皮细胞完整性,因此用磷酸 -抗体阵列测量内皮细胞的变化,显示磷酸化蛋白水平的降低能够调节血管通透性(图7D,E)。肺是黑色素瘤转移的主要部位之一,实验证明具有低水平的ROCK-肌球蛋白II的黑素瘤细胞可以不改变肺毛细血管通透性,并且与对照组相比定植肺的效率较低(图7F-H)。因此,具有高活性和分泌潜力的肌球蛋白II变形虫黑素瘤细胞一旦达到转移部位就具有一定优势,他们能改造了内皮细胞骨架细胞和增加血管通透性以定植肺。
结论:
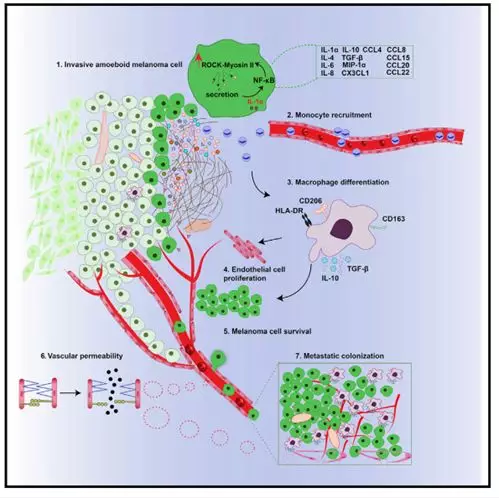
本研究表明,研究者定义了癌细胞中肌球蛋白II动力学的新调节作用超越细胞运动的内在控制,这有助于变形虫肿瘤的侵袭和以细胞自主方式的转移。变形虫癌细胞在后期转移阶段保留其分泌潜能,是由于在转移性定植期间,它们具有通过破坏内皮连接和增加内皮细胞通透性的优势。因此,变形虫癌细胞能够劫持这些有效的机制,如典型的免疫细胞去改变脉管系统。对于变形虫癌细胞分泌物,它们的组成是一些复杂的富含免疫调节细胞因子,趋化因子和生长因子,因此,研究者证明通过ROCK-Myosin-II驱动的分泌和IL-1a/ NF-kB信号传导之间的正反馈循环维持变形虫行为,产生强大的信号放大电路。
另一方面,阻断黑素瘤细胞中分泌的IL-1a足以减少NF-kB激活和变形虫特征,抗IL-1a的单克隆抗体已经在临床试验阶段。研究者证明变形虫黑色素瘤细胞分布区域的肌球蛋白II具有高活性,可能通过建立肿瘤支持性的AATME而导致缺乏治疗反应。此外,手术切除原发性黑色素瘤病变后,应对患者使用靶向变形虫表型的ROCKi或IL-1a的阻断抗体作为后续疗法来限制免疫抑制微环境和转移性传播。
使用Raybio AAH-CYT-4000 成功找出机制中的关键因子IL-1α,为研究者阐明肿瘤进展机制研究提供重大帮助。
做芯片,找RayBio!





