RayBiotech抗体芯片在肿瘤转移发生机制研究中的应用
杂志名称:Nature Communications
文献题目:OuzounovaM, Lee E, Piranlioglu R, et al. Monocytic and granulocytic myeloid derivedsuppressor cells differentially regulate spatiotemporal tumour plasticityduring metastatic cascade[J]. Nature communications, 2017, 8: 14979.
第一作者:Maria Ouzounova
作者单位:Department of Biochemistry and Molecular Biology, Georgia CancerCenter, Augusta University, Augusta, Georgia 30912, USA.
本实验所用产品:AAM-CYT-C1000(96个细胞因子抗体芯片)
实验样品:细胞培养上清
研究背景:
临床前和临床环境的研究证据表明,恶性细胞转移是一个早期的过程。大多数转移的细胞在循环中被清除或在包括骨髓在内的远处器官中保持休眠,而极少数细胞最终发展成功的转移。因此,细胞成功转移的机制至关重要。一些器官比其他器官更有利于传播肿瘤细胞“种子'”生长,成功的转移需要发展成恶性细胞并消除抗肿瘤应答,一小部分(转移)细胞 的“种植” - 经历上皮 - 间质转化(EMT)与癌症干细胞(CSC)表型发生,在远处器官中的成功定植需要通过间充质 - 上皮细胞转化(MET)使转移的肿瘤恢复到上皮表型以促进肿瘤细胞增殖。此外,EMT和MET状态之间的动态和可逆转变已被证明是驱动鳞状细胞癌转移的关键过程。与此相一致的是,单独的EMT标记不能预测大多数恶性肿瘤的转移,新的证据表明肿瘤浸润的免疫细胞(主要来源于骨髓)分化成促进肿瘤生长和侵袭的细胞, MDSCs是包含单核细胞(mMDSC)和粒细胞(gMDSC)亚群的未成熟骨髓细胞的异质群体,两者都显示出免疫抑制。 MDSCs在肿瘤转移机制机制尚未明确,而研究之间的关系对研究肿瘤转移机制有重要意义。

1 结果
1.1 分组
非转移性乳腺癌细胞67NR、EMT6上清
转移性乳腺癌细胞4T1上清
1.2 小鼠乳腺肿瘤在动物模型中的表征
为了研究免疫系统在转移过程中的作用,我们在同基因(BALB/ c)小鼠异种移植模型中使用转移性(4T1)和较少侵入性(EMT6)的鼠乳腺细胞系。首先证实了EMT6和4T1肿瘤的致瘤性和转移能力,当两个细胞的50,000个细胞注射到乳房脂肪垫中时,它们在8周内产生相似大小的肿瘤(图1a)。然而,4T1肿瘤早在植入后1周就表现出肺浸润,并在100%动物中出现自发转移5周(图1b),脾脏尺寸和重量也增大(图1c,d)。为了确定4T1鼠肿瘤的转移能力是否表现出上皮 - 间质转化(EMT)表型并且具有癌症干细胞(CSC)特性,使用如前所述的CD29和CD24抗体对鼠乳腺干细胞标记。免疫荧光染色和流式细胞仪分析显示,在无血清培养条件下,4T1细胞与EMT6细胞相比显示更高的Vimentin表达,并且通过CD29 + CD24 +表型评估显示有更高比例的CSC。
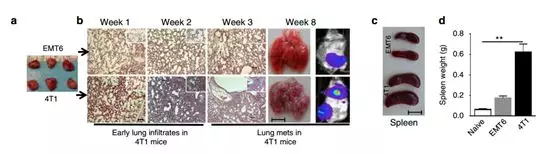
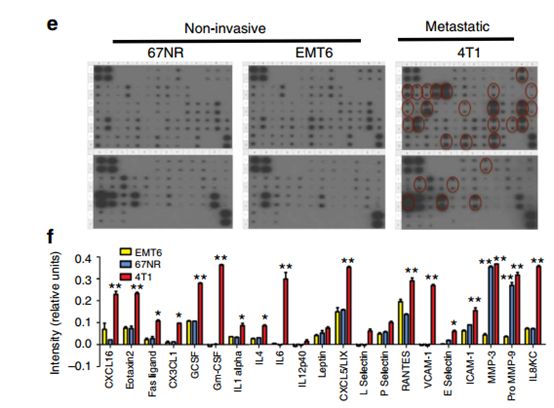
为了确定4T1鼠肿瘤细胞是否也分泌更高水平的炎症细胞因子,使用RayBiotech细胞因子抗体芯片,其证明与非转移性EMT6或67NR细胞相比,转移性4T1肿瘤细胞分泌更高水平的炎症细胞因子,包括IL6,IL8,RANTES,G-CSF,GM-CSF,IL12,CXCL16,CXCL5和VCAM的趋化因子(图1e,f)。先前的研究表明,SOCS3负向调节炎症细胞因子,与这些数据一致。与67NR和EMT6细胞相比,4T1细胞表达更低水平的SOCS3蛋白,并且可以解释4T1细胞中更高的细胞因子产生的现象。
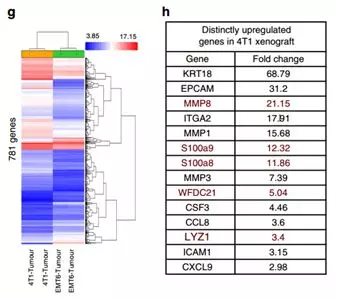
尽管在功能性小鼠移植研究中4T1肿瘤与EMT6相比的转移性质已得到确认,但是缺乏详细的比较性基因表达分析。因此,进行小鼠转录组分析,结果表明4T1与EMT6异种移植物之间差异表达有781个基因(图1g)。其中涉及转移的基因,在4T1肿瘤中以较高水平表达。
1.3 转移性肿瘤对MDSCs的诱导和浸润
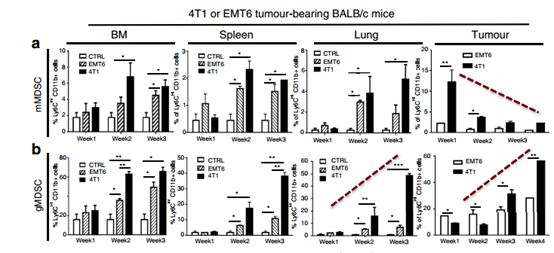
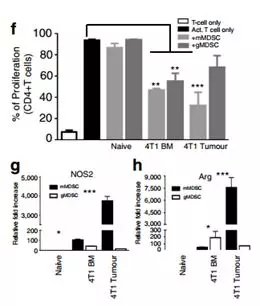
MDSCs是具有两个主要亚群的不成熟的髓细胞群体,mMDSC和gMDSC。然而,这些肿瘤中MDSC亚群的身份及其与肿瘤相互作用的分子机制仍然难以捉摸。研究人员在EMT6或4T1肿瘤植入后1-4周研究了在原发性肿瘤,骨髓,脾和肺中的mMDSC和gMDSC的系统性诱导和浸润。结果证明在4T1肿瘤中检测到早期浸润(早至1周)的原发性肿瘤中的mMDSCs,并在第4周时逐渐增加gMDSC(图2a,b)。虽然与携带4T1肿瘤的小鼠的原发性肿瘤浸润相比,肺部mMDSC浸润较低,但在检测肺部转移性病变之前,第3周肺部gMDSC浸润增加了410倍(图2a,b)(图1b )。肿瘤衍生的mMDSCs在体外表现出较高水平的T细胞抑制,这可能是由于较高水平的一氧化氮合酶(NOS2)和精氨酸酶1(ARG1;图2g,h)造成的。这些发现表明,mMDSCs和gMDSCs分别在原发肿瘤和肺中浸润,除了抑制抗肿瘤免疫应答外,还能促进转移。
1.4 用mMDSC诱导EMT / CSC
为了研究MDSC子集对肿瘤的影响,将mMDSC和gMDSC子集从含有4T1肿瘤的动物的骨髓中独立地流动分选,并且与弱转移性EMT6细胞共培养。mMDSCs对肿瘤细胞表现出强亲和力并诱导EMT表型(图3b-e)。相反,gMDSCs不能诱导EMT标志物的表达(图3b-e)。Vimentin和Twist的表达只有来自携带4T1荷瘤小鼠的mMDSCs(图3f-红色条)与来自EMT6荷瘤动物的mMDSCs(图3f-黄色条)相比才上调。
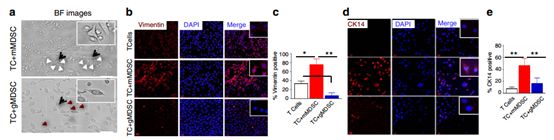
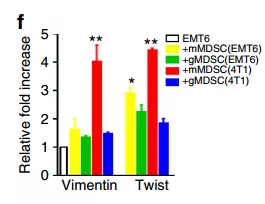
EMT标志物的表达增加与肿瘤细胞的侵袭性增强相关。与此相一致的是,与mMDSCs共培养时EMT6细胞的侵袭增强,而gMDSCs适度(不显着)抑制了这一过程(图3g,h)。研究者接下来推测,mMDSC诱导EMT是否也导致了CSC数量的扩大。将EMT6细胞与来自4T1肿瘤生长的小鼠的mMDSC共培养。通过CD24 + CD29 +表型评估,EMT6细胞含有一小部分(41%)的CSC群体,但是当与mMDSC共培养时,CSC数量的扩增超过三倍,而与gMDSCs共培养对CSC水平没有影响(图3i)。
1.5 由mMDSC产生的NOS2诱导肿瘤EMT / CSC表型出现
为了确定MDSC诱导的全局基因表达谱,我们进行了小鼠转录组分析。在植入后1周从原发性肿瘤和4T1荷瘤小鼠的BM获得的MDSC利用Ly6C和CD11b表面抗体进行流式分选。结果显示来自BM或肿瘤的mMDSC和gMDSC亚型显示出不同的基因表达谱,具有超过1,000个差异表达基因。此外,mMDSC显示许多EMT相关基因如IL1a,IL6,TGFB1和NOS2的表达升高。相比之下,gMDSC显示不同组的基因如S100A8,S100A9,MMP8和TGFb3的表达(图4a)。当与mMDSC或gMDSCs共培养时,数百个基因在EMT6肿瘤细胞中不同地表达(图4b)。与mMDSC共同培养的肿瘤细胞显示EMT相关基因的上调超过两倍(图4b,c)。
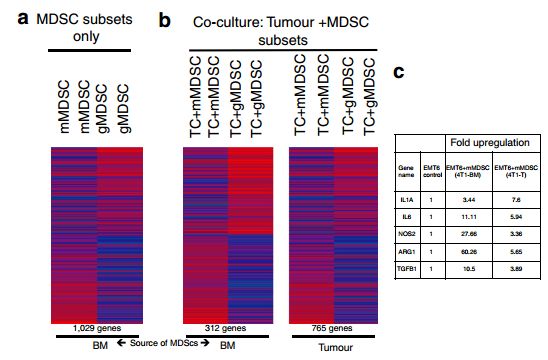
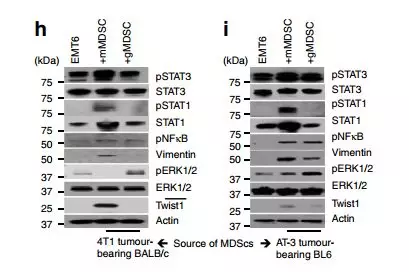
为了确定MDSC亚群对主要信号传导途径的影响,在与mMDSCs或gMDSCs共同培养过夜后,对肿瘤细胞裂解物进行western试验。数据进行基因表达分析,显示MDSC亚群对肿瘤细胞具有不同的作用。如在4T1 / BALB/ c和AT-3 / C57BL / 6J肿瘤模型中所示,mMDSC诱导pStat1,pStat3和pNF-kB的强上调以及增强的波形蛋白和扭曲在肿瘤细胞中的表达,同时抑制pERK1 / 2活动(图4h,我)。相比之下,gMDSCs显示出增强的pERK1 / 2活性,而对pStat1和pStat3活化没有影响(图4h,i)。
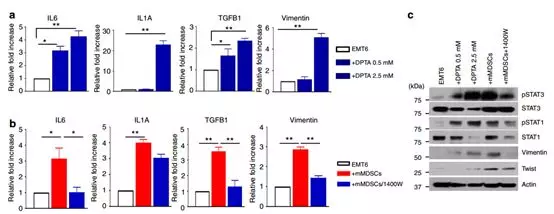
接下来试图确定升高的NOS2水平是否在肿瘤细胞中诱导EMT / CSC表型。用NOS2供体,DPTA处理EMT6细胞诱导所示基因的表达, IL1A,IL6,TGFB1和VIM以剂量依赖性方式通过qPCR分析确定(图5a)。与这些发现一致,NOS2抑制剂1400W能够抑制mMDSC诱导的这些基因的转录(图5b)。期望的是,DPTA激活NOS2诱导了pStat1和pStat3信号通路的激活以及EMT标志物,波形蛋白水平,而NOS2抑制剂1400W抑制了后者途径和EMT标志物的激活(图5c)。为了评估NOS2介导的EMT相关基因诱导表达,我们在存在和不存在NOS2供体DPTA的情况下进行体外肿瘤侵袭能力测试。用DPTA处理肿瘤细胞引起肿瘤细胞转移增加,然而,通过1400 W阻断NOS2,抑制了mMDSC介导的肿瘤细胞侵袭。相同的是,NOS2激活也扩大了CSC数量,而NOS2阻断减少了mMDSC诱导的CSC细胞数量。总之,这些数据表明,mMDSCs可能通过诱导NOS2产生发挥其对肿瘤细胞的作用。
1.6 G-MDSC促进原发性和播散性肿瘤细胞生长
接下来在体外共培养条件下检查MDSC亚群对肿瘤细胞生长的影响。由于4T1肿瘤在100%的动物中发生自发的肺转移并且在植入后3周显示肺中的gMDSC渗透,所以我们推断肺浸润的gMDSC可能支持转移性生长。为了检验这个假设,将EMT6肿瘤细胞与来自骨髓(BM),携带4T1肿瘤的小鼠的肿瘤或肺的mMDSC或gMDSC共培养。而来源于肺(60%)或肿瘤(40%)的gMDSCs增强肿瘤细胞增殖,相反,骨髓来源的mMDSC或gMDSCs却没有这样做(图6a,b)。
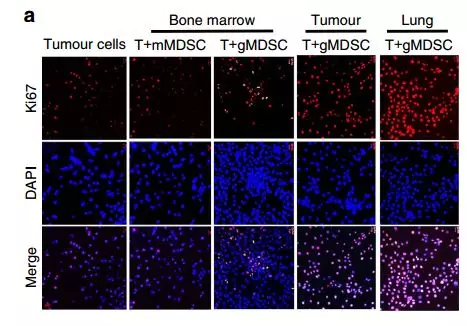
进一步证实,携带4T1荷瘤小鼠的肺源性gMDSCs比EMT6荷瘤小鼠的gMDSCs更有效促进肿瘤细胞增殖。
结论:
目前的研究表明,在远端器官中的成功定植需要具有EMT表型的转移性肿瘤细胞通过MET恢复至上皮表型。MDSC是未成熟的骨髓细胞,包括单核细胞和粒细胞亚群,两者都显示出免疫抑制。尽管大多数研究并没有区分这两个亚群,本研究提供了第一个证据,即单核细胞和粒细胞亚群不仅具有独特的分子特性,而且对肿瘤细胞也有相反的作用。mMDSCs对肿瘤细胞的强烈亲和力导致通过上调EMT基因表达诱导EMT / CSC表型,而gMDSC诱导与增殖信号相关的因子的上调。通过mMDSCs在肿瘤细胞中激活Stat1和Stat3信号传导途径可以解释EMT / CSC表型的诱导表达的现象。本研究初步研究MDSCs在肿瘤转移机制,对研究肿瘤转移治疗有重要意义,RayBiotech在本研究中起重要作用。
做芯片,找RayBio!





