RayBiotech抗体芯片在肿瘤转移及耐药机制研究的应用
杂志名称:American Association for Cancer research
文献题目:Bao X, Shi J, Xie F, et al. Proteolytic release of the p75NTR intracellular domain by ADAM10 promotes metastasis and resistance to anoikis[J]. Cancer research, 2018, 78(9): 2262-2276.
第一作者:Xin Bao, Jianbo Shi
通讯作者:Zhiyuan Zhang
作者单位:Department of Oral and Maxillofacial-Head Neck Oncology, Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, National Clinical Research Center for Oral Diseases, Shanghai Key Laboratory of Stomatology, Shanghai 200011, China
本实验所用产品:AAH-APOSIG-1
实验样品:
65名口腔癌患者手术切割的癌组织(30名患者(46.1%)组织学检查有淋巴结转移,35名患者(53.9%)没有淋巴结转移)
由癌症中心提供的60名乳腺癌患者的癌组织(27名患者(45%)发现有肿瘤转移,33名患者(55%)没有)人头颈部鳞状细胞癌HN-4 与HN-12细胞系和乳腺癌MCF-7与MDA-MB-231细胞系
研究背景:
肿瘤迁移是恶性肿瘤治愈率低的原因之一,肿瘤迁移是指癌细胞从发病器官上脱离下来,通过血液循环系统,转移到其他位点。失巢凋亡是由于细胞与细胞外基质和其他细胞失去接触而诱导的一种特殊的程序化细胞死亡形式,失巢凋亡可作为阻碍细胞迁移的一种生理屏障。ADAM10(人解整合素样金属蛋白酶10)能裂解许多膜结合蛋白,影响信号通路和细胞生物学行为,有研究表明,ADAM10对游离肿瘤细胞具有潜在作用,能提高肿瘤细胞在循环系统中的生存p75NTR(p75神经营养蛋白受体)属于肿瘤坏死因子受体超家族,本文作者发现, ADAM10可以裂解p75NTR,随后在癌细胞形成p75NTR胞内域(ICD)。本文将证明ADAM10介导形成的p75NTRICD有利于体内肿瘤转移。

1 结果
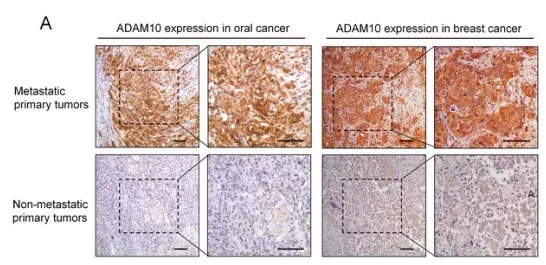
1.1 ADAM10的表达量升高与高转移性癌细胞有关联
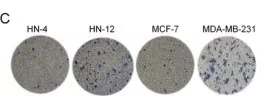
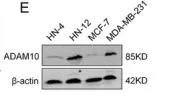
探究ADAM10表达量与癌细胞高转移性的关联性。原代原发性肿瘤样品进行免疫组化,发现在口腔癌和乳腺癌组织中ADAM10表达量升高(图a)。进行癌细胞侵袭实验,相对于 HN-4 和MCF-7 细胞系,HN-12和MDA-MB-231 细胞系的侵袭潜力更强(图c)。免疫印迹验证ADAM10在高侵袭潜力细胞中内源性高表达(图e)。
1.2 ADAM10的蛋白水解活性促进癌细胞侵袭并抵制失巢凋亡,但不影响细胞正常增殖和凋亡
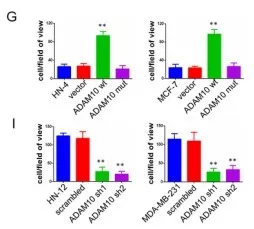
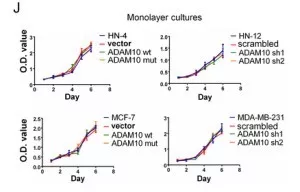
进一步探究ADAM10对癌细胞的生物学作用。选取ADAM10基因(野生型wt、突变型mut、基因沉默,基因干扰shRNA),PCR后转染到癌细胞中,HN-4和MCF-7细胞(转染wt和mut,只有wt增强细胞侵袭能力),HN-12 和MDA-MB-231细胞(转染通过shRNA的基因干扰,85%的ADAM10抑制),沉默的ADAM10降低了细胞的侵袭能力(图g/i)。评估ADAM10对细胞增殖的作用,发现野生型、突变型和基因沉默处理都不影响细胞增殖(图j)。说明ADAM10蛋白水解活性能促进癌细胞侵袭并抵抗失巢凋亡,但不影响正常细胞的增殖和凋亡。
1.3 在抵制失巢凋亡的细胞中ADAM10介导P75NTR水解
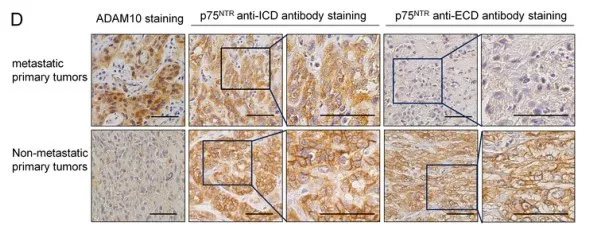
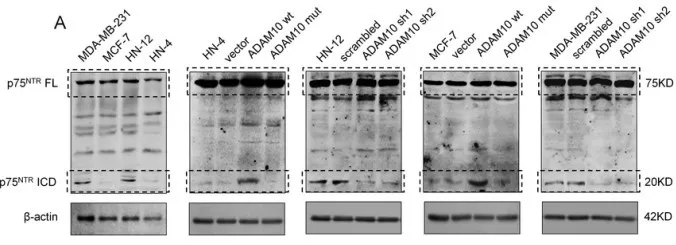
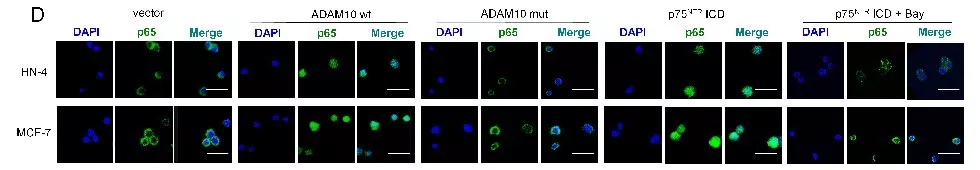
有报道,ADAM10蛋白酶通过使蛋白胞外域脱落调控不同的生物学信号。结合上述研究,假设ADAM10是通过调控基质蛋白降解诱导失巢凋亡抵抗。实验发现20 kDa p75NTR ICD只存在抵抗失巢凋亡的HN-12和MDA-MB-231 细胞中;过表达的ADAM10wt,在悬浮的HN-4 和 MCF-7 细胞,诱导p75NTRICD形成(图a)。通过对癌细胞p75NTR ICD 和 p75NTRECD染色评估p75NTR的表达量,发现p75NTR表达量和ADAM10 表达水平有关。在ADAM10阳性细胞中,发现p75NTRICD存在于细胞质中,缺少p75NTRECD,该现象说明p75NTR ICD蛋白被裂解。在ADAM10阴性细胞中,发现p75NTR ICD和p75NTR ECD存在于细胞膜上,该现象说明细胞膜锚定的p75NTR ICD蛋白未被裂解(图d)。
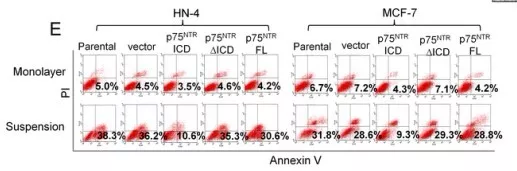
1.4 p75NTR ICD直接诱导细胞抵制失巢凋亡,但不影响正常凋亡
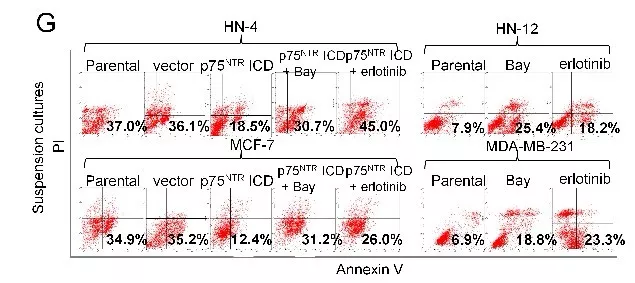
对HN-4 和MCF-7 细胞进行处理,使其表达p75NTRFL, p75NTR∆ICD 和 p75NTRICD。流式细胞活性分析,发现p75NTR ICD异位表达和转染p75NTR wt /ADAM10的HN-4 和 MCF-7细胞的失巢凋亡比例减少(图e)。对这些样品进行免疫印迹(WB)分析发现高表达的p75NTR ICD 能减少PARP裂解,与p75NTR ICD诱导失巢凋亡减少相符(图g)。p75NTRICD对贴壁培养的细胞正常凋亡没有影响,没有发现p75NTRFL和 p75NTR∆ICD在非失巢凋亡和正常凋亡的细胞中起作用。说明p75NTR ICD直接促进癌细胞抵抗失巢凋亡,基本不影响正常凋亡。
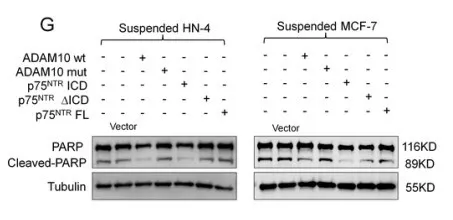
1.5 癌细胞脱落后,p75NTRICD选择性激活NF-κB信号
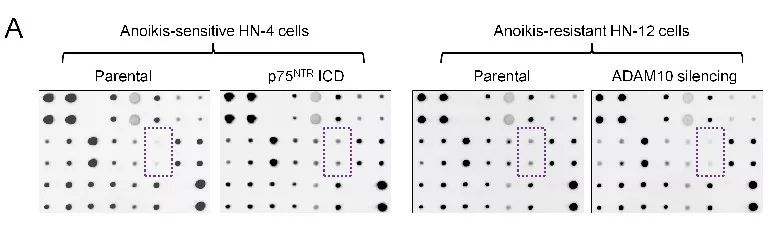
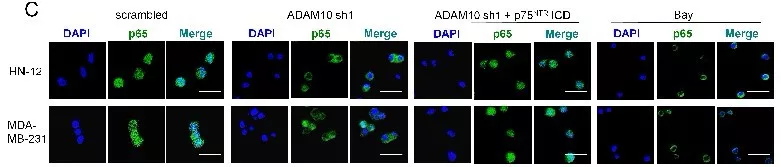
对失巢凋亡敏感性的悬浮细胞进行p75NTRICD处理,检测失巢凋亡/正常凋亡的相关信号。使用人类细胞凋亡信号检测试剂盒对细胞裂解液中19个凋亡因子进行检测,发现p75NTRICD处理的悬浮细胞IκB-α磷酸化升高(图a)。IκB-α磷酸化能导致NF-κB信号的激活,说明NF-κB信号与p75NTRICD诱导抵制凋亡有关,可能存在于p75NTRICD诱导的抵抗失巢凋亡的癌细胞中。通过免疫荧光检测细胞核中NF-κB p65亚基,发现表达p75NTRICD抵抗凋亡的癌细胞中存在激活的NF-κB信号(图c/d)。说明在悬浮癌细胞中,p75NTR ICD 的存在能诱导 NF-κB激活。流式检测p75NTRICD诱导抵制凋亡的癌细胞活性(图g)。
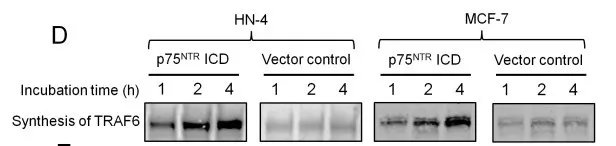
1.6 p75NTR ICD促进TRAF6在翻译中的表达
TRAF6,一种重要的调节因子,对p75NTR调节信号转导有重要作用。为了判断TRAF6是否参与了p75NTR ICD选择性激活NF-κB的过程,在p75NTRICD诱导的失巢凋亡敏感性的贴壁细胞和失巢凋亡抵抗性的悬浮细胞中检测TRAF6的表达量(图d)。结果表明p75NTRICD促进TRAF6蛋白在翻译中的表达。
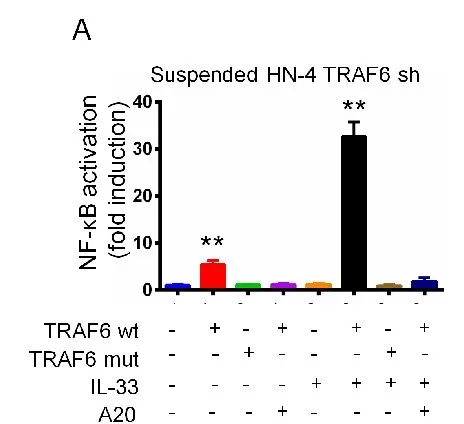
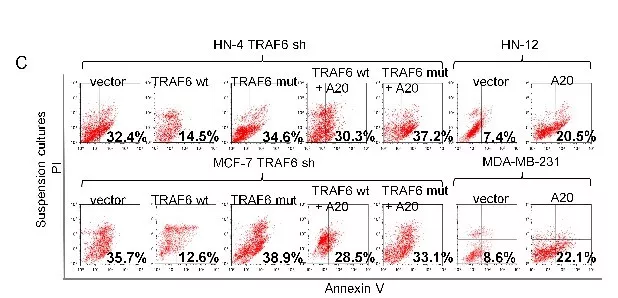
1.7 TRAF6的自动泛素化诱导NF-κB激活和抵抗失巢凋亡
近期研究,TRAF6泛素化在激活NF-κB信号中有重要作用。通过实验,表明TRAF6通过E3连接酶自身进行泛素化且失去黏附作用的细胞能促进TRAF6泛素化。同时,p75NTR不直接影响TRAF6泛素化。进一步验证在游离细胞中TRAF6自身泛素化是否诱导NF-κB激活,抑制内源性TRAF6表达后,NF-κB标记质粒(TRAF6wt 和 TRAF6 mut)转染细胞,IL-33处理悬浮培养(IL-33能诱导TRAF6自身泛素化),发现TRAF6wt过表达的细胞使NF-κB 激活增多。(图a)说明,TRAF6蛋白的自动泛素化诱导NF-κB激活和抵抗失巢凋亡.(图c)
1.8 细胞脱落介导的EGFR激活诱导TRAF6的自动泛素化
为了判断是哪个信号作用于TRAF6泛素化,进行了探究。发现悬浮细胞中有FAK脱磷酸化和EGFR磷酸化(图d)。进一步验证,发现FAK激活不影响TRAF6泛素化,说明可能是EGFR激活诱导TRAF6的自动泛素化。说明细胞脱落介导的EGFR激活诱导TRAF6的自动泛素化。
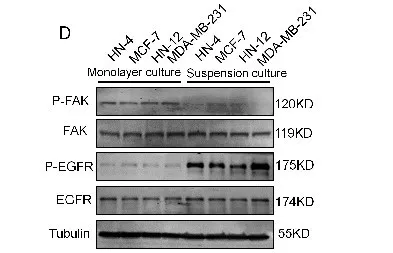
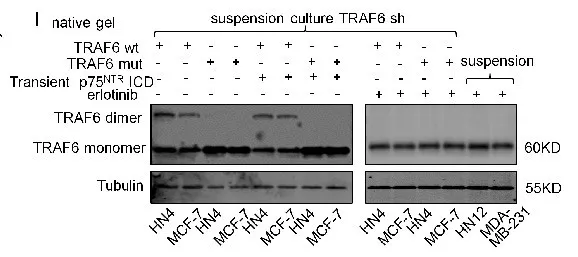
1.9 EGFR信号促进TRAF6二聚化
进一步探究EGFR信号怎么诱导TRAF6泛素化。有研究表明,E3连接酶活化TRAF6蛋白是使其结构二聚化。经过凝胶电泳检测TRAF6 wt或TRAF6 nut在贴壁细胞和悬浮细胞中的二聚化情况,说明EGFR信号促进TRAF6二聚化(图i)。
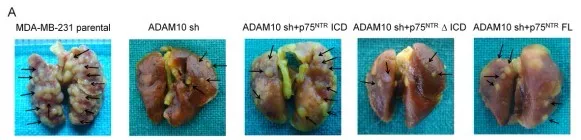
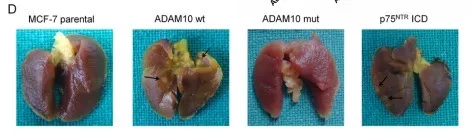
2.0 ADAM10和p75NTR ICD有助于癌症转移
通过小鼠模型,发现ADAM10和p75NTR ICD有助于癌症转移在体内。
结论:
本研究揭示了一个新的信号通路:ADAM10-p75NTR ICD-TRAF6-NF-κB对抵抗失巢凋亡的促进作用,肿瘤迁移是恶性肿瘤的一个基本特征,该研究可为肿瘤迁移机制提供一个参考,有助于进一步的研究。RayBio芯片在本文中为发现NF-κB提供重要作用。
做芯片,找RayBio!





