RayBiotech抗体芯片在CAFs与肿瘤耐药性研究中的应用
杂志名称:Cell
文献题目:Su S, Chen J, Yao H, et al. CD10+ GPR77+ cancer-associated fibroblasts promote cancer formation and chemoresistance by sustaining cancer stemness[J]. Cell, 2018, 172(4): 841-856. e16.
第一作者:ShichengSu, JianingChen, HeruiYao
通讯作者:ErweiSong
作者单位:Guangdong Provincial Key Laboratory of Malignant Tumor Epigenetics and Gene Regulation, Medical Research Center, Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510120, China
本实验所用产品:RayBiotech人AAH-CYT-5抗体芯片(80个细胞因子抗体芯片)
实验样品:细胞上清
研究背景:
肿瘤干细胞(CSCs)是对肿瘤形成和肿瘤耐药性起到重要作用的细胞群,但未有对其的标记物。肿瘤相关成纤维细胞(CAFs)是许多恶性肿瘤(如乳腺癌/肺癌等)共有的癌细胞,许多研究表明CAFs在肿瘤形成和恶化过程中对肿瘤干细胞(CSCs)有影响,但由于CAFs有许多不同的亚群,各自分泌不同的细胞因子,无法判断出是哪一类CAF作用于CSCs。本文旨在探究是哪一类CAFs亚群分泌了哪些蛋白分子影响CSCs,使其对化疗药物产生抗性,促使癌症发展。

1 结果
1.1 验证在乳腺癌和肺癌患者中发现的一种高表达CD10和GPR77的CAF细胞亚群与肿瘤耐药性和低存活的相关性
为了探究是哪一种CAFs亚群影响肿瘤耐药性和低存活,收集了578位化疗前后的乳腺癌患者的组织样品,分离出CAF同癌细胞共培养,发现耐药性癌组织中CAF对癌细胞有影响。采用mRNA芯片检测mRNA表达量,发现CD10和GPR77基因表达量上调,流式免疫荧光染色,表明CD10和GPR77蛋白在耐药性肿瘤组织CAF中的表达。
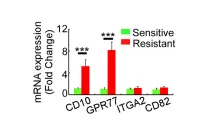
1.2 验证CD10+GPR77+CAF诱导癌细胞耐受和自身耐受
为探究高表达CD10和GPR77的CAF亚群是否通过诱导细胞耐受影响癌细胞,收集CD10+GPR77+ CAF,同抑制药物处理的癌细胞共培养,发现CD10+GPR77+ CAF有效维持了癌细胞系和原代癌细胞的存活。
为更明显的说明诱导效果,注射癌细胞到免疫功能不全的小鼠乳腺中,建立移植瘤小鼠模型。发现CD10+GPR77+ CAF不止自身抵抗化疗,还能诱导肿瘤细胞在其CAF微环境影响下耐受。
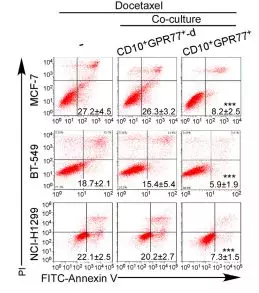
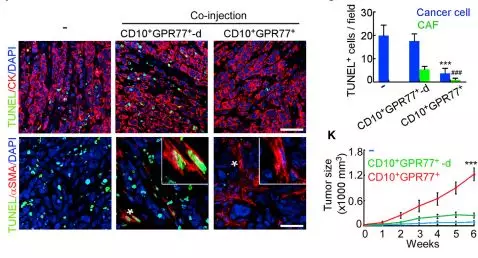
1.3 验证CD10+GPR77+CAF组成CSCs 的Supporting Niche(微环境)
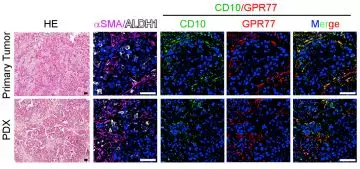
由于在乳腺癌耐药性样本中发现ALDH1+ CSCs的比例升高,进行临床乳腺癌CSCs和CD10+GPR77 CAF的相关性实验,在ALDH1+CSCs中发现CD10+GPR77+ CAF,建立派生瘤模型(PDX),进一步探究在移植瘤模型中CD10+GPR77+CAF是否有助于肿瘤形成的能力,发现了乳腺癌基质中的CD10+GPR77+CAFs有助于PDX的建模和通过CSC增殖形成肿瘤的能力。

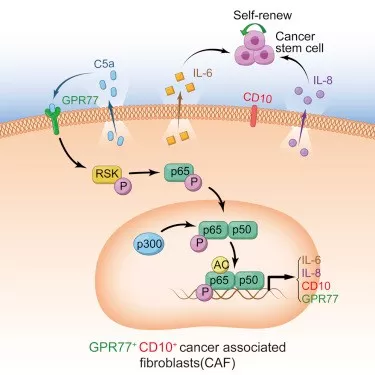
1.4 RayBiotech芯片研究CD10+GPR77+ CAFs作用机制
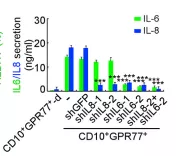
为探究CD10+GPR77+ CAFs的作用机制,使用人类蛋白抗体芯片检测了CD10+GPR77+CAFs分泌的蛋白因子,通过蛋白板检测CD10+GPR77+CAFs分泌蛋白,发现了IL-6 和 IL-8蛋白量在CD10+GPR77+CAF明显增多,说明CD10+GPR77+ CAF通过分泌IL-6 和 IL-8,促进CSC增殖和肿瘤派生转移,诱导肿瘤耐受性,分别进行沉默IL-8基因和IL6基因,发现CD10+GPR77+CAFs产生IL-8,IL-8依赖于IL6调控。
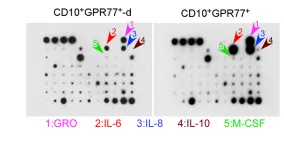
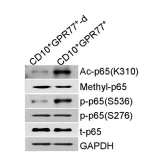
1.5 验证通过P300调控P65乙酰化延迟NF-kB激活,以维持CD10+GPR77+CAFs的表型和功能
为解释CD10+GPR77+CAFs持续产生IL6和IL8激活信号通路的机制,进行了富集分析GSEA(gene set enrichment analysis)、WB(Western Blotting)发现在CAFs中,通过p65磷酸化(S536)和乙酰化(K310)维持 NF-kB的活化,同时也需要其他分子信号(如IKK活化)参与。免疫沉淀反应发现p65与p300的相互作用影响其在K310的乙酰化。

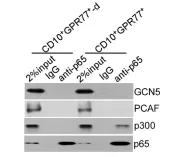
1.6 验证在CD10+GPR77+CAFs中,GPR77诱导P65磷酸化是p65乙酰化和参与NF-kB活化的前提
进一步探究CD10和GPR77 蛋白是否在CD10+GPR77+CAFs中参与信号通路和维持细胞功能。敲除GPR77基因,发现IL6和IL8分泌明显减少,NF-kB活化受到抑制,p65蛋白减少,。沉默GPR77完全抑制RSK1的表达,对IKK没有明显影响。说明GPR77诱导P65磷酸化是p65乙酰化和参与NF-kB活化的前提。在MCF-7共培养乳腺癌细胞中,沉默GPR77可终止CD10+GPR77+ CAFs促进CSC增殖和耐药性的能力。由于GPR77是C5a补体的受体,进一步探究CAF自身是否产生维持GPR77信号表达的补体。发现在CD10+GPR77+CAFs产生较多C5a补体。(6J/6K)且NF-kB调控C5a产生。
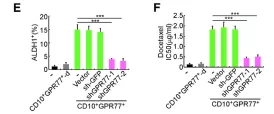

1.7 抗GPR77肿瘤抑制剂和提高化疗效果治疗胸腺癌派生瘤模型
进一步探究 anti-GPR77结合抗体用于治疗植入派生瘤小鼠的潜在疗效。结果说明,封闭GPR77的结合抗体,可作为一种有效的治疗方法用于抑制胸腺癌肿瘤发生并提高化疗效果。

结论:
本研究在乳腺癌和肺癌组织中发现CD10+GPR77+CAFs与耐药性和低存活率相关,进行实验发现CD10+GPR77+ CAFs 诱导癌细胞耐受和诱导CSCs增殖。使用人类蛋白抗体芯片发现CD10+GPR77+CAF通过分泌IL-6 和 IL-8促进CSC增殖和肿瘤派生移植的形成,诱导肿瘤耐受性。该作用机制还需GPR77蛋白诱导P65磷酸化,使得p65乙酰化并参与NF-kB活化P300调解P65乙酰化延迟NF-kB激活,以维持CD10+GPR77+ CAFs的表型和功能。通过Human Cytokine AntibodyArrays V kit (AAH-CYT-5) 检测CD10+GPR77+CAFs分泌蛋白,推进了本研究对CD10+GPR77+ CAFs诱导CSCs增殖机制的进展。该研究确立了CAF的两类分子标志物,揭示了它们促进肿瘤干细胞增殖和抗药的作用机制,发现了CAF“助纣为虐”的手段,为确立新的癌症治疗靶点和开发靶向药物提供了证据支持。
做芯片,找RayBio!





